Últimas notícias do evento
Bem Vindos
Bem Vindos
Na época tecnológica em que vivemos, a partilha de informação da mais popular até a
científica é um dado adquirido.
Pensamos que a nossa área profissional a da Saúde, seja um dos temas mais debatidos
no planeta, devido às implicações que tem com o nosso dia -a -dia.
Não existia até agora um local onde verdadeiramente pudéssemos trocar opiniões,
expor atualizações e falar da Saúde em geral para todo o mundo, desde técnicos a
leigos, vamos debater e partilhar informação na área da Saúde de uma forma honesta,
séria e global…
Bem Vindos ao Blog : maismaismedicina.ga
Enviar artigos ao e-mail: cjldo2013@gmail.com.
Esperamos a vossa colaboração
Carlos Dinis MD
Juan Ortiz Rubio MD
La #leche materna de las madres seropositivas a COVID-19 contiene anticuerpos específicos contra el SARA-CoV-2
- Heather Mason
- Noticias
- 28 jul. 2021
Según un estudio publicado en Archives of Disease in Childhood: Fetal & Neonatal, los anticuerpos presentes en la leche materna de madres seropositivas contienen anticuerpos específicos contra el SARS-CoV-2, capaces de neutralizar el virus in vitro incluso después de una infección leve o asintomática.
Los investigadores realizaron una revisión sistemática de publicaciones que informaban sobre la inmunidad de la leche materna y la infección entre mujeres lactantes con COVID-19 y estudios en los que se analizó la leche materna para detectar anticuerpos contra el SARS-CoV-2. El análisis incluyó 14 estudios, que informaron sobre 161 participantes.
Los resultados mostraron la presencia de inmunoglobulina A (IgA), IgM y/o IgG anti-SARS-CoV-2 en la leche materna de 133 (82,6 %) participantes. Se disponía de datos sobre la gravedad de la enfermedad en 146: cinco (3,4 %) con enfermedad grave, 128 (87,7%) con enfermedad leve y 13 (8,9 %) asintomáticos. La leche de 62 de los 79 (78,5%) participantes analizados contenía IgA específica para el SARS-CoV-2.
Se evaluó la capacidad de neutralización viral de la leche humana tras la pasteurización Holder en las muestras de 30 participantes y la pasteurización de alta presión en las muestras de 29. Aunque los niveles de IgA permanecieron inalterados, la función neutralizadora se redujo significativamente o se perdió tras la pasteurización Holder. En cambio, la leche tratada con pasteurización a alta presión siguió siendo eficaz para neutralizar el virus.
Low JM, Low YW, Zhong Y, Lee CYC, Chan M, Ng NBH, et al. Titres and neutralising capacity of SARS-CoV-2-specific antibodies in human milk: a systematic review. Arch Dis Child Fetal Neonatal Ed 2021:fetalneonatal-2021-322156. https://doi.org/10.1136/archdischild-2021-322156.
#Cabello cuidado y sano en verano gracias a estos seis consejos

Tras el baño, hay que ducharse y quitar los restos de cloro y sal del pelo.
El pelo en verano necesita un extra de hidratación porque la exposición prolongada al sol lo reseca


ANDREA PÉREZ 24 JUL 16:00HSE LEE EN3 MINUTOS
El sol, la sal y el cloro afecta a la salud de nuestro pelo. En verano podemos notar un mayor encrespamiento, sequedad e incluso un incremento en la caída de nuestro cabello. Por ello, cuidarlo en esta época es importante y en la farmacia hay numerosos productos para hacerlo como artículos de higiene o protectores solares. En este artículo enumeramos varios consejos sobre el cuidado del pelo en verano con la ayuda de los profesionales farmacéuticos y de la Asociación para el Autocuidado de la Salud (Anefp).
Consejos para el cuidado del pelo en verano
Si queremos seguir teniendo una melena sana, tenemos que seguir las siguientes recomendaciones que nos da Anefp:
- No abusar de secadores y planchas. “Su uso excesivo puede contribuir a la deshidratación del cabello y, además, dañar la cutícula y provocar su caída”, indican desde Anefp. Además, durante la época estival el pelo se seca rápidamente, así que es el momento perfecto para dejar aparcadas las planchas y los secadores.
- Eliminar los restos de cloro y sal tras cada baño. Se recomienda que después de salir de la piscina o de la playa pasemos por la ducha para aclararnos el pelo y quitar cualquier rastro de cloro y sal que pueda quedar.
- Utiliza protector solar para el pelo. ¿No sabías que existía? Sí, al igual que hay protector solar para la piel, también podemos encontrar este productos específicamente para el cabello.
- A la hora de lavar el pelo en verano, tienes que tener en cuenta que necesita un extra de hidratación, así que no escatimes en mascarillas hidratantes. En esta misma línea, asegúrate de utilizar un champú adecuado para tu tipo de cabello.
- Peina tu cabello con peines de púa ancha y cuando esté mojado. De esta forma, se evita que se rompa y se dañe el pelo.
- Por último, también es recomendable utilizar gorras, pañuelos o sombreros que protegen la cabeza y el pelo de las radiaciones solares.
En las farmacias podemos encontrar muchos productos para seguir este ritual como champús, mascarillas, protectores solares para el pelo, peines, etc.
Cuidar el pelo durante todo el año
Aunque el verano es una época en la que el cabello sufre más de lo habitual, la farmacéutica María-Josep Divins en su artículo ‘Cuidado del Cabello‘ indica que no se deben hacer cuidados puntuales solo durante el momento estival.
“La salud del cabello depende de cómo sea tratado durante todo el año. Para ello es fundamental, antes que nada, que cada persona sea capaz de identificar bien su tipo de cabello, ya que, de esta manera sabrá identificar también aquellos productos que pueden ser los más adecuados”, afirma la experta.
En este sentido, la profesional señala que el cabello debe lavarse siempre con agua tibia y si se lava cada día habrá que hacerlo con champús de “uso frecuente” o “neutros” nunca con champús de tratamiento. “Estos últimos son más agresivos y podrían eliminar los aceites protectores del pelo”, especifica.
Además, desmiente el mito de que lavar mucho el cabello incrementa la secreción de grasa y la caída del pelo. “El cabello que cae con los lavados ya está previamente dañado. En cuanto al tema del cabello graso, al tratarse de un tema fundamentalmente hormonal, no por lavarlo más, habrá mayor secreción”, subraya Divins. “Lavándolo de manera frecuente con productos muy suaves, no solo mejorará su aspecto sino también su salud”, añade.
Aged 40+ With Diabetes Hit Badly by COVID-19, Should Be Vaccine Priority
People with type 2 diabetes as young as 40 years of age face a disproportionately increased risk of dying from COVID-19 infection, indicates a UK analysis of three large-scale datasets that shines a light on the need to prioritize vaccinations in younger vulnerable patient groups.
The research was published February 8 in the journal Diabetologia.
The majority of European countries have prioritized COVID-19 vaccinations for people with type 2 diabetes, but typically only at age 50 and older. However, the data from the current study suggest that this age limit should be lowered.
“It’s important to remember the risk to middle-aged people with diabetes of dying from COVID-19 is very low in absolute terms compared with the elderly,” said lead researcher Andrew P. McGovern, MD, of Royal Devon & Exeter Hospital, Exeter, United Kingdom, in a press release from his institution.
However, he said that “strategies to define priority groups for vaccination must consider the disproportionate relative risk of COVID-19 mortality in middle-aged people with type 2 diabetes whose COVID-19 risk is already elevated by their age.”
McGovern told Medscape Medical News that the magnitude of the effect of type 2 diabetes on COVID-19 deaths “is really what’s surprising” about these new findings, and “not what you would expect.”
He said it is therefore crucial that people with diabetes are put “into the queue” for the vaccine “in the right place, and obviously in countries where the vaccine rollout will be slower, it is more important.”
Bridget Turner, director of policy campaigns and improvement at Diabetes UK, which funded the study, said the results give “important new insights into how much type 2 diabetes adds to the overall risk of dying from coronavirus at different ages, particularly the additional risk that the condition adds in middle-age.”https://c275ced267b81d32d592c3471da53348.safeframe.googlesyndication.com/safeframe/1-0-37/html/container.html
“The UK has made good progress on prioritizing those who are most vulnerable for vaccination, which includes all adults with diabetes,” she added in the press release, “but we need to continue to work at pace to identify and protect those individuals at higher risk.”
Relationship Between COVID Death and Diabetes Is Complex
The authors note that the relationship between COVID-19-related mortality and type 2 diabetes is not simply an “additive effect of diabetes and age-related risk” but appears to be a “more complex” association, with a “disproportionately higher excess relative mortality risk in younger people with diabetes.”
To investigate this, they examined data from two UK population-based studies that had previously reported age-specific hazard ratios for COVID-19 mortality associated with diabetes:
- OpenSAFELY, which included 17.2 million people, of whom 8.8% had diabetes, and had an overall 90-day mortality rate of 0.06%
- QCOVID, comprising 6 million individuals, of whom 7% had diabetes, and had an overall 97-day mortality rate of 0.07%.
The team also looked at data on type 2 diabetes patients with severe COVID-19 from the COVID-19 Hospitalisation in England Surveillance System (CHESS), which contained 19,256 patients admitted to critical care in England, of whom 18.3% had diabetes.
The 30-day in-hospital mortality rate in this study was 26.4%.
They translated the mortality hazard ratios associated with COVID-19 infection in people with diabetes into a “COVID-age,” which equates to the additional years of “death risk” added to an individual’s chronological age if diabetes is present.https://c275ced267b81d32d592c3471da53348.safeframe.googlesyndication.com/safeframe/1-0-37/html/container.html
Taking the QCOVID dataset as an example, the results showed that the “COVID-age” associated with diabetes for someone aged 40 years was 20.4 years; that would indicate that their “mortality risk [for COVID-19] is similar to that of a 60-year-old person without diabetes.”
The impact of diabetes on the COVID-19 death risk decreased with increasing age, such that a diabetes patient aged 50 years had a COVID-age of 16.4 years. This fell to 12.1 years in someone aged 60, and 8.1 years in someone 70 years of age, which means the latter has the same risk of death from COVID-19 as someone without diabetes who is 78.
Similar results were obtained when the team looked at data from the OpenSAFELY study.
But when they looked at the effect of diabetes on COVID-19 mortality risk in the CHESS dataset, it was less pronounced.
Just Looking at Diabetes Is Oversimplistic, but It’s an Easy Marker for Vaccination
The researchers acknowledge that “considering only age and diabetes status when assessing COVID-19-associated risks…is an oversimplification,” as factors such as body mass index (BMI), diabetes duration, and glycemic control are also known to play a role.
However, they say consideration of these factors is “not practical for population-level vaccine rollout.”
“The time-critical nature of population COVID-19 vaccination necessitates pragmatic group-level prioritization, which is the approach initiated by governments thus far,” the team concludes.
This study was supported by Diabetes UK. Study author John M. Dennis is supported by an Independent Fellowship funded by Research England’s Expanding Excellence in England (E3) fund and by the NIHR Exeter Clinical Research Facility. McGovern is supported by the NIHR Exeter Clinical Research Facility.
Diabetologia. Published online February 8, 2021. Full text
Medscape Medical News © 2021
Cite this: Aged 40+ With Diabetes Hit Badly by COVID-19, Should Be Vaccine Priority – Medscape – Feb 15, 2021.TOP PICKS FOR YOU
« Le cœur à l’oeil » ou Salves de tachycardie atriale rapides induites par un analogue de la prostaglandine F2a en collyre
Patrick DAUDON et coll*, service de cardiologie du CHR d’Orléans
Un patient de 70 ans, médecin à la retraite qui continue à exercer, ressent soudainement un léger étourdissement indéfinissable lors d’une discussion véhémente.
Observation
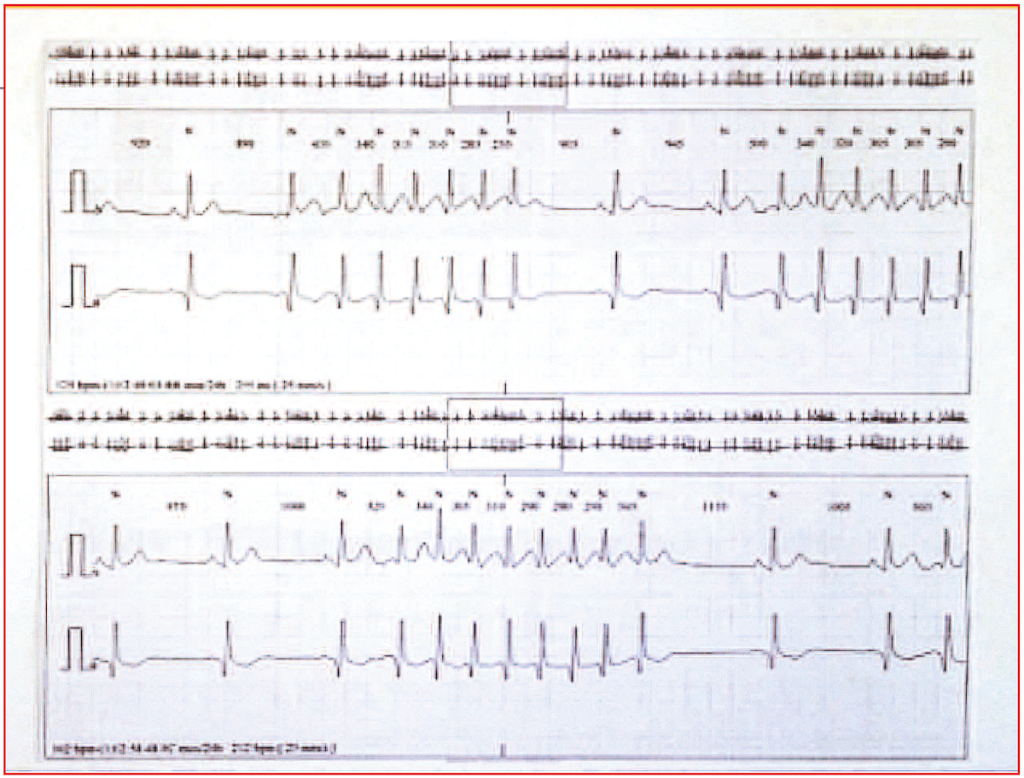
Ce patient de 70 ans, médecin à la retraite qui continue à exercer, ressent soudainement un léger étourdissement indéfinissable lors d’une discussion véhémente. En s’examinant, il note une arythmie cardiaque nette isolée. L’ECG confirme l’arythmie (figure 1) avec des salves de tachycardie atriale (TA) brèves, rapides (de 150 à 190/min), de 4 à 10 complexes avec retour en rythme sinusal sur 1 à 2 complexes, ainsi de suite. L’échocardiogramme montre un ventricule gauche, des valves, des cavités droites et un péricarde normaux. Une épreuve d’effort couplée à une scintigraphie myocardique, réalisée deux mois avant, était maximale et négative. Un bilan biologique complet, comprenant notamment : NFS, CRP, ionogramme sanguin, TSH, D-Dimères, troponine, BNP, s’avère strictement normal. Le patient est mis sous apixaban 5 et bisoprolol 2,5. Un Holter sur 24 heures est réalisé au 4e jour de ce traitement et montre la persistance de l’arythmie en salves courtes quasi permanentes, plusieurs milliers par 24 heures (figure 2). Pendant les 2 à 3 jours avant que la cause ne fût découverte, le seul symptôme était un bref étourdissement en règle en parlant.
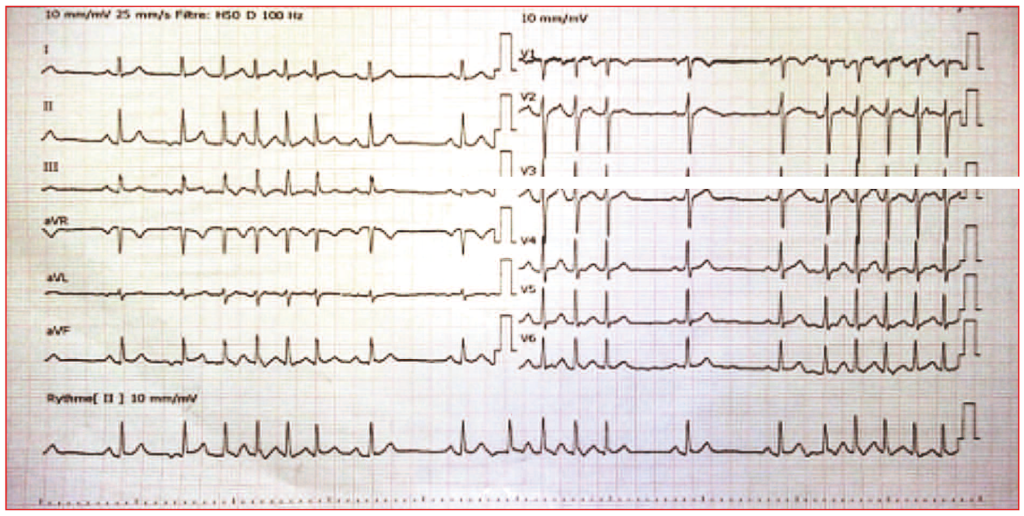
Figure 1. ECG avec salves de tachycardie atriale (TA) récidivantes.
Figure 2. Holter avec salves de TA incessantes sur les 24 heures.
Discussion
Une cause toxique a été rapidement évoquée devant cette excitabilité sur cœur apparemment sain, mais kaliémie et TSH notamment étaient, comme on l’a vu, normales. Le patient qui nous avait dit ne prendre aucun médicament nous précise au 3e jour que, depuis 8 mois, tous les soirs à 19 heures, il met une goutte de latanoprost dans l’œil gauche à la demande de son ophtalmologiste.
Ce traitement local a rapidement permis de baisser la pression oculaire de cet œil de 26 à 17.
Le lanatoprost est un analogue de la prostaglandine F2a. Sous forme de solution collyre délivrée en récipient unidose de 0,2 ml dosé à 50 μg/ml, il a pour effet d’augmenter l’écoulement de l’humeur aqueuse ce qui contribue à faire diminuer la pression dans l’œil qui doit rester inférieure à 20.
Pratiquement pas métabolisé dans l’oeil, son métabolisme est principalement hépatique. Sa demi-vie est de 17 heures. Ses métabolites ont une activité faible à nulle et sont principalement éliminés dans les urines. Sur la notice d’utilisation de ce collyre, il est précisé qu’après avoir déposé une goutte dans l’œil à traiter, il faut appuyer légèrement avec le doigt sur le coin interne de l’œil, proche du nez, pendant une minute tout en gardant l’œil fermé (figure 3).

Figure 3. Comment administrer le collyre. (A) Dépôt de la goutte. (B) Compression à l’angle interne de l’oeil.
Le patient avait vu ce détail, mais a dit qu’il ne le faisait pas, pensant que son oeil avait été assez bien instillé sans cette compression, et qu’il ne voulait pas prendre le risque d’irriter son œil avec le doigt. Cette compression digitale de l’angle de l’œil vise en fait à occlure l’orifice d’entrée du canal lacrymal et éviter ainsi les effets systémiques du produit du fait de l’absorption par la muqueuse. L’arrêt du collyre sera efficace dès la 12e heure avec de très rares extrasystoles puis la normalisation complète de l’ECG avant la 24e heure. Le bisoprolol est arrêté. Un Holter de contrôle, réalisé trois jours après l’arrêt du bêtabloqueur, est strictement normal.
Cet effet indésirable à type d’étourdissement ou de palpitation est apparemment connu et rare (1 patient sur 10 000). En pharmacovigilance, en France, 2 cas de tachycardie régressant à l’arrêt ont été signalés, et dans le monde, 11 cas de fibrillation atriale ont été rapportés, dont 3 pour lesquels l’évolution est connue et a été favorable à l’arrêt du traitement. Notre observation est particulièrement bien documentée objectivant des milliers de salves de tachycardie atriale, sur cœur apparemment sain, rapidement régressives à l’arrêt du collyre.

Transição Menopausal: como prevenir doenças cardiovasculares?
As doenças cardiovasculares, como AVC e doenças isquêmicas cardíacas, são as recordistas de causas mortis no mundo. Desde 2011, a Associação Americana de Cardiologia tem orientado para que olhemos com maior atenção para algumas particularidades relacionadas à transição menopausal, momento particularmente frágil, mas importante, para iniciar a prevenção dos agravos cardiovasculares na saúde feminina.
No final de 2020, um artigo interessante publicado no periódico Circulation apontou alguns dados relevantes para serem observados, em particular nessa população de mulheres:

Dados sobre a transição menopausal
- Transição da menopausa é um momento de aumento de risco cardiovascular para a mulher.
- Algumas doenças endócrinas e metabólicas estão intimamente ligadas a essa época, sendo fatores de piora de prognóstico.
- A ligação entre transição menopausal e doença cardiovascular é bidirecional.
- A transição para menopausa traz piora do perfil metabólico para a mulher, independente da época em que ocorra.
- Diabetes é um fator de risco para doenças cardiovasculares, tanto em homens como em mulheres. Sua prevalência aumentada está associada ao status menopausal na mulher.
- Ainda não existem estratégias preventivas efetivas, (como mudança do estilo de vida) que sejam específicas para essas mulheres nesse período.
- As terapias hipolipemiantes nunca se mostraram eficazes na prevenção primária de doenças cardiovasculares em mulheres e até mesmo as evidências sobre a prevenção secundária são escassas.
- A terapia hormonal da menopausa (iniciada em mulheres com menos de 60 anos ou dentro de 10 anos da menopausa para aliviar os sintomas da menopausa e prevenir ou tratar a osteoporose) é atualmente a única intervenção que diminui o risco de doença cardiovascular e diabetes em mulheres saudáveis na meia idade.
Assim sendo, torna-se importante dentro das estratégias de atenção à saúde da mulher, atenção a esse período muitas vezes desassistido por algumas mulheres apresentarem poucos sintomas. Torna-se mister a orientação para tratamento e prevenção dos eventos cardiovasculares na atenção primária na saúde da mulher.
Autor:
João Marcelo Martins Coluna
Médico Ginecologista e Obstetra formado pela Universidade Estadual de Londrina • Mestrado em Fisiopatologia pela Unoeste (Universidade Oeste Paulista) • Docente da Unoeste (Presidente Prudente) – departamento materno infantil • Preceptor Residência Médica Hospital Regional Presidente Prudente – SP • Plantonista Ginecologia e Obstetrícia Hospital Regional Presidente Prudente • Plantonista Ginecologia e Obstetrícia Hospital Estadual Dr. Odilo Antunes Siqueira (Presidente Prudente – SP) • Plantonista Ginecologia e Obstetrícia Santa Casa de Misericórdia de Adamantina
Plantonista Socorrista Santa Casa de Misericórdia Presidente Prudente • Médico Regulador ambulatorial município de Dracena – SP • Médico Preceptor ambulatorial UNIFADRA (Dracena – SP) • Ginecologista do serviço ambulatorial de Narandiba (SP) • Ginecologista e Obstetra do serviço ambulatorial de Pirapozinho (SP).
Referência bibliográfica:
- Nappi, Rossella E e Simoncini, Tommaso. https://www.thelancet.com/journals/landia/article/PIIS2213-8587(21)00018-8/fulltext
Ingestão de vitamina B12 pré-natal materna e desenvolvimento na infância
As deficiências de muitos nutrientes na gravidez têm efeitos adversos no desenvolvimento do cérebro do feto, com consequente comprometimento da função cognitiva na infância. Alguns estudos já demostraram de forma muito clara efeitos adversos identificáveis no nascimento para crianças nascidas de mulheres com deficiências vitamínicas, como por exemplo, parto prematuro e defeitos do tubo neural.
Estamos em um momento em que o vegetarianismo e o veganismo estão se tornando mais populares, e as mulheres que possuem esse hábito podem ter sua dieta inadequada em nutrientes como a vitamina B12. No entanto, não está claro se a deficiência dessa vitamina no período pré-natal é prejudicial ao feto.
O desenvolvimento do cérebro é mais rápido nos primeiros anos de vida, o que pode torná-lo mais vulnerável a deficiências nutricionais. Alguns estudos sobre neurodesenvolvimento observaram que bebês com atrofia cerebral e desmielinização de células nervosas, ao receberem vitamina B12 responderam de forma surpreendente, apresentando uma rápida melhora nos sintomas neurológicos.

Novas evidências
No dia 30 de dezembro de 2020, a revista Nutrition Research publicou um estudo realizado no Reino Unido correlacionando a ingesta de vitamina B12 na gestação com o desenvolvimento cognitivo infantil.
O estudo selecionou aproximadamente 10 mil gestantes e seus filhos. As mães, na trigésima segunda semana de gestação, respondiam um questionário que detalhava sua alimentação e calculava dessa forma a quantidade de vitamina B12 ingerida. Aos 8 anos de idade, os filhos destas pacientes passavam por uma avaliação cognitiva, que incluíam testes de fala e linguagem, soletração, leitura, matemática e ciências e QI.
Resultados
O trabalho evidenciou que os filhos de pacientes com o menor consumo de B12 estavam em maior risco de vocabulário pobre aos 24 meses, capacidade reduzida de combinar palavras aos 38 meses, baixa inteligibilidade de fala aos 6 anos, baixa compreensão de matemática no quarto e sexto anos (idades de 8-9 e 10-11 anos) e resultados insatisfatórios nos testes nacionais de matemática (13 anos). Não houve tais associações ajustadas significativas para habilidades de leitura ou ortografia, ou para QI verbal ou de escala total (quociente de inteligência) em 8 ou em 15.
Pontos fracos do estudo
O estudo não avaliou pacientes com ingesta muito limitada de Vitamina B12, que pode ocorrer por exemplo em países subdesenvolvidos, bem como não foi avaliada a ingesta da vitamina no início da gestação. Além disso, pacientes com baixa ingesta de vitamina B12 também podem ter outras carências nutricionais, o que gera um fator de confundimento.
Conclusão
Dessa forma, observamos que existem efeitos adversos no desenvolvimento da criança se a gestante tiver uma baixa ingestão de vitamina B12, principalmente para certas habilidades matemáticas e de fala.
Autor(a):
Juliana Olivieri
Graduada em Medicina pela Universidade Federal do Rio de Janeiro (UFRJ) ⦁ Ginecologista e Obstetra ⦁ Pós-graduada em Endocrinologia Feminina e Climatério pelo Instituto Nacional de Saúde da Mulher da Criança e do Adolescente Fernandes Figueira(IFF/Fiocruz)
Referências bibliográficas:
- Jean Golding, Steven Gregory, Rosie Clark, Yasmin Iles-Caven, Genette Ellis, Caroline M. Taylor, Joseph Hibbeln, Maternal prenatal vitamin B12 intake is associated with speech development and mathematical abilities in childhood. Nutrition Research. 2021;86:68-78. doi: 10.1016/j.nutres.2020.12.005.
Túnel carpiano agudo y parálisis nerviosa: patologías de la mano no descritas en pacientes covid
Una serie de pacientes sugiere que el SARS-CoV-2 causaría compresiones nerviosas agudas en los nervios mediano y cubital asociadas a problemas en la mano

Anosmia, ageusia, parálisis facial y óculo-motora… el ‘rastro’ que deja el nuevo coronavirus en el sistema nervioso periférico, una vez resuelta la infección, parece no tener fin. Cada día se descubre una nueva patología asociada a esta infección viral. Para el traumatólogo Juan González del Pino, experto en cirugía de la mano, muñeca y microcirugía dela Policlínica Nuestra Señora del Rosario, en Ibiza, el virus también puede afectar los nervios de la mano, produciendo desde una parálisis de instauración rápida a un síndrome del túnel carpiano agudo.
Así lo ha constatado en al menos ocho pacientes atendidos recientemente. Todos habían superado una infección por SARS-CoV-2, la mayoría con síntomas leves, como pérdida de olfato o gusto, síntomas catarrales, fiebre o dolores musculares. Sin embargo, todos terminaron al cabo de unos meses de la enfermedad con neuropatías localizadas en el codo y la mano.
El cirujano describe cuándo empezó a darse cuenta de la posibilidad de esta nueva patología: “En octubre de 2020, atendí a un hombre de 72 años con atrofia de la musculatura de ambas manos que se había producido en un brevísimo periodo de tiempo. Tenía una parálisis completa bilateral del nervio cubital, responsable de la sensibilidad de los dedos anular y meñique, del movimiento fino y preciso de los dedos, y de parte de las funciones de la pinza del pulgar. Además tenía un síndrome del túnel carpiano en ambas manos de inicio después de su enfermedad. Me aseguraba que hacía 3-4 meses no tenía esas deformidades, ni atrofias y que utilizaba las manos con total normalidad. Al preguntarle sobre enfermedades previas o actuales me indicó que había sufrido infección por coronavirus. Empecé a relacionarlo con la situación clínica y descubrí que había una causa-efecto entre el covid-19 y las neuropatías que el paciente presentaba”.
La historia se repitió en noviembre con varias mujeres de entre 45 y 65 años, que acudieron a su consulta con una evolución idéntica y que igualmente habían estado infectadas por el coronavirus. “El patrón se repetía: enfermedad en la primera ola y desarrollo de atrofias musculares en verano, o enfermedad en la segunda ola y establecimiento de la parálisis entre noviembre y diciembre. Como estos pacientes no tienen dolor, sólo fueron conscientes del problema cuando habían perdido la forma, la destreza y la fuerza de la mano”.
Tras un estudio de esos pacientes con pruebas específicas de conducción nerviosa, constató “un bloqueo agudo y casi completo de la actividad nerviosa en el canal cubital del codo, lo que en términos prácticos se asemejaba a una sección del nervio”.
Dada esta rápida evolución y la comprobación del bloqueo casi completo de la actividad nerviosa mediante los estudios específicos, González del Pino optó por una cirugía de liberación de manera inmediata. “Ya he intervenido los primeros pacientes y los hallazgos son sorprendentes: el nervio discurre en el interior de una canal de por sí estrecho, pero pude ver que el ligamento que forma su pared se había retraído, endurecido y lo comprimía, como si hubiera sido estrangulado por una brida apretada al máximo. Se tenía la sensación de que en la zona de máxima compresión el nervio estaba vacío, como si no hubiera nada dentro: los grupos fasciculares que permiten la conducción nerviosa se encontraban extremadamente adelgazados, asemejando un reloj de arena“.
Tras la cirugía de descompresión y transposición del nervio, “incluyendo su vascularización a una zona bajo la musculatura flexo-pronadora de mejores características biomecánicas, en los primeros días los pacientes notaron mejora de la sensibilidad, coordinación de los movimientos finos de la mano y desaparición de las deformidades en garra de los dedos. Aunque no se puede presuponer el éxito a largo plazo, los resultados preliminares son extraordinariamente esperanzadores”, expone.
El especialista opina que probablemente otros colegas en el mundo habrán visto lesiones similares, si bien no hay nada publicado de forma explícita al respecto.
Lo llamativo de estos cuadros es “la velocidad con que se instaura el problema: parálisis producidas en 2-4 meses y no en 10-15 años, que es lo normal cuando el nervio cubital se atrapa en el codo. A pesar de no tener un conocimiento completo de estos problemas en los pacientes con covid-19, la lógica dice que cuanto antes se descomprima el nervio del túnel que lo estrangula, mayores son las posibilidades de recuperación, por eso la cirugía inmediata es, en mi opinión, la única forma de tratamiento: si no se hace rápidamente los músculos atrofiados degeneran, se fibrosan y pierden su capacidad de recuperación”.
Respecto a la evolución a largo plazo, evita hacer afirmaciones rotundas, “porque las toxinas del virus también dañan la fibra nerviosa, pero esta cirugía permite recuperar el riego sanguíneo del nervio y ayudar de forma evidente a su recuperación”.
Síndrome del túnel carpiano agudo
Además de las atrofias musculares debidas a parálisis cubital, González del Pino relaciona ciertos casos del síndrome del túnel carpiano agudo con el Covid, según ha podido observar en varias mujeres de mediana edad. “En este caso no se produce parálisis, sino un dolor repentino e hiperagudo, brusco y violento, que se manifiesta en los dedos pulgar, índice y corazón, y que se incrementa por la noche, impidiendo conciliar el sueño. Algunas ya tenían síntomas leves antes de contraer la infección y se agravaron bruscamente, y otras eran totalmente asintomáticas. En todos los casos el dolor les hace despertarse varias veces, obliga a levantarse, meter las manos en agua fría o caliente y moverlas para mitigar, sólo parcialmente, el dolor. Y así durante semanas. Los estudios de actividad nerviosa reflejaron igualmente afectación grave del nervio mediano a su paso por la muñeca. El denominador común en todas ellas es haber pasado la enfermedad en primavera o después del verano”.
De nuevo se imponía una cirugía inmediata de liberación del nervio, que “produjo la desaparición absoluta e inmediata del dolor y la recuperación completa de la sensibilidad en la primera semana”.
Causas múltiples
En cuanto a la etiopatogenia, González del Pino indica que es multifactorial. No hay apenas bibliografía explícita al respecto, explica, pero “extrapolando la existente a mis casos puedo sugerir como causa probable un proceso de desmielinización focal por inflamación de origen autoinmune, pero no puede descartarse un efecto neurotóxico directo del coronavirus sobre la fibra nerviosa. Determinados nervios (cubital, mediano y ciático-políteo externo) en determinadas zonas estrechas (canal cubital en el codo, túnel carpiano y cabeza del peroné) pudieran ser más susceptibles a fenómenos isquémicos secundarios a vasculitis (afectación endotelial secundaria a “tormenta de citoquinas”), reducción de la microcirculación nerviosa por microtromosis, neuropatía autoinmune o toxicidad directa sobre la fibra nerviosa. Tampoco se puede descartar la posibilidad de neuropatía desmielinizante inflamatoria (“estatus de hiperinflamación e hipercoagulabilidad”). Algunos autores han encontrado parálisis nerviosas de las extremidades por compresión mantenida secundarios a posición prona en pacientes en UVI por distress respiratorio agudo o por hematoma organizado secundario a anticoagulación o edema perineural residual. En estos casos los nervios más afectados son el cubital en el codo y el ciático poplíteo externo en la rodilla. Sin embargo ninguno de nuestros pacientes estuvo ingresado ni recibió tratamiento anticoagulante, por lo que la teoría posicional o hemorrágica puede descartarse”.
Por estos motivos, continúa, parece que la compresión (atrapamiento) se produce de novo en zonas susceptibles por sus especiales características anatómicas (canal cubital en el codo y túnel carpiano), aunque desencadenada por una causa aún no bien dilucidada y probablemente múltiple: respuesta hiperinmune con inflamación, isquemia nerviosa y neurotoxicidad directa a cualquiera de las estructuras nerviosas, vainas o contenido fascicular.
“El agravamiento de nuestros pacientes con síndrome del túnel carpiano también está en la base de estos hechos (edema intracanal y disminución de la microcirculación intraneural del nervio mediano), aunque no existen datos que puedan corroborar una u otra causa”.
Otros efectos músculo-esqueléticos
El cirujano alude a otros posibles efectos de la covid-19 en el sistema músculo-esquelético de los brazos. “He atendido pacientes con “codo de tenista” y diversas tendinitis de la muñeca, así como agravamiento de la enfermedad de Dupuytren”.
Ante los casos descritos, advierte a los pacientes de “que si se despiertan bruscamente con dolor y adormecimiento en las manos (sobre todo por la noche), y a aquellos que noten cómo adelgaza su mano y pierden la habilidad de uso, que acudan al especialista de Traumatología o a un experto en cirugía de la mano”.
La prescripción diferida de #antibióticos en niños con infecciones respiratorias es segura y efectiva
Esta es la conclusión de un ensayo clínico publicado ayer en ‘Pediatrics’ confirma que esta estrategia satisface a los padres y reduce el uso inadecuado de antibióticos.

Un ensayo clínico realizado en España ha demostrado que la prescripción diferida de antibióticos es segura y efectiva para tratar las infecciones respiratorias no complicadas en niños. Esta estrategia, comparada con la prescripción inmediata de antibióticos, disminuye notablemente el uso de estos fármacos y es igual de satisfactoria para los padres, según los resultados de este trabajo, coordinado por investigadores del Centro Cochrane Iberoamericano (CCIB) y cuyos resultados se publican ayer en la revista Pediatrics.
Este ensayo se ha realizado en 39 centros de salud españoles, con 436 niños de 2-14 años que acudieron con sus padres al pediatra por infecciones respiratorias (faringitis, rinosinusitis, otitis media aguda o bronquitis aguda).
La condición para participar en el ensayo era que el pediatra tuviera dudas de si era necesario o no el tratamiento con antibióticos. En ese caso, se asignó al azar una de estas tres intervenciones: se recetó un antibiótico, no se recetó un antibiótico o se hizo una prescripción diferida. De este modo, se ha podido comprobar que no hay diferencias en cuanto a la duración y gravedad de los síntomas entre las tres estrategias.
“La razón por la que no se han observado diferencias entre las tres intervenciones es probablemente que los antibióticos influyen muy poco en la evolución de estas infecciones porque la mayoría son víricas y autolimitadas”, argumenta Gemma Mas-Dalmau, enfermera del Hospital Sant Pau, de Barcelona, y primera firmante del artículo.
Los resultados del ensayo también muestran que las complicaciones y las visitas adicionales al pediatra o a urgencias de un hospital fueron escasas y similares en las tres intervenciones.
Como especifican a este CF, Mas-Dalmau y Pablo Alonso, investigador del CCIB y del Instituto de Investigaciones Biomédicas Sant Pau, de Barcelona, y autor de correspondencia del trabajo, “el antibiótico principalmente utilizado, tanto en aquellos niños que fueron asignados a la estrategia de prescripción diferida como a la estrategia inmediata y no antibiótico, fue la amoxicilina. Cada médico prescribía el antibiótico que pensaba que era el más adecuado, según la infección y otros factores, como las resistencias locales”.
Pablo Alonso sostiene que la prescripción diferida de antibióticos “es una estrategia válida para un uso más racional de los antibióticos. No solo evita sus efectos adversos, sino que ayuda a reducir el grave problema de las resistencias microbianas”. Y añade: “Ayuda a combatir la creencia errónea de que los antibióticos son necesarios en este tipo de infecciones y a educar a los padres sobre el problema de las resistencias”.
De hecho, los datos del ensayo muestran que “solo el 25% de los niños asignados a la estrategia de prescripción diferida en nuestro estudio finalmente tomaron antibiótico, en comparación con el 96% de los niños asignados a la estrategia de antibiótico inmediata y el 12% de los que estaban en la estrategia de no antibiótico, sin presentarse diferencias en las complicaciones. El consumo de antibiótico, en nuestro estudio, fue un poco menor en los niños asignados en la estrategia de prescripción diferida en comparación con los estudios previos”.
Los autores recuerdan a este medio que la prescripción diferida de antibióticos “es una estrategia de utilidad en el tratamiento de niños que acuden a sus centros de salud por infecciones respiratorias no complicadas (bronquitis aguda, otitis media aguda, faringitis y rinosinusitis), sin criterios de gravedad, como sospecha de neumonía, y que, además, el pediatra tiene dudas razonables del diagnóstico y la necesidad de prescripción de antibióticos de forma inmediata. Asimismo, la prescripción diferida puede ser útil en situaciones de duda, en las cuales los padres esperan la receta del antibiótico, como una manera de ofrecer seguridad y, a la vez, tiempo para la posible resolución de la enfermedad sin antibiótico”.
Con la colaboración de los farmacéuticos
Ana Molinero, vicepresidenta 1ª de la Sociedad Española de Farmacia Clínica, Familiar y Comunitaria (Sefac), corrobora lo dicho por los expertos responsables del trabajo y aporta cifras interesantes de la Agencia Española de Medicamentos y Productos Sanitarios (Aemps), que apuntan que “alrededor del 40% de las prescripciones realizadas en Atención Primaria serían innecesarias“, dice. Por este motivo ve “realmente útil” la prescripción diferida de antibióticos tanto en niños como en población adulta. “Eso sí, creo que habría que contar con el farmacéutico comunitario para que hiciese una evaluación previa a la dispensación final del antibiótico y, utilizando protocolos consensuados, realizase ésta o no la realizase. No creo que sea la mejor solución dejar la decisión final de administrar el antibiótico al paciente o a los padres, a no ser que haya una educación previa sobre el consumo del mismo”, propone. En estos casos, el papel del farmacéutico es “evaluar la situación, y en función de si existen criterios (previamente consensuados con sociedades científicas médicas) que indiquen que el paciente va a necesitar un antibiótico derive al médico para que evalúe la situación y si esos criterios no existen le indique la no conveniencia de utilizar el antibiótico y si lo cree necesario ofrecer un tratamiento alternativo“.
Para la portavoz de Sefac, esta colaboración les permitiría “poner en valor nuestro papel como profesional sanitario experto en medicamentos”.
En su opinión, esta estrategia, “es una manera de ahorrar recursos sanitarios, evitando que los padres tengan que volver al cabo de unos días para que vuelva a ser evaluado el niño por el pediatra”.
Con fecha de dispensación
Ahora bien, esta farmacéutica propone que para que realmente sea efectiva la prescripción diferida de antibióticos y los padres no den el antibiótico a las primeras de cambio, se ponga una fecha de dispensación, “que tendría que ser unos días después“. De no hacerlo, “los padres -continúan- compran el antibiótico para tenerlo en casa en ese momento y así dárselo en cuanto lo crean conveniente o guardarlo para otra ocasión similar, con el peligro que eso conlleva en cuanto a la utilización de un medicamento innecesario e incluso inseguro. Y ello por no hablar de facilitar la aparición de resistencias bacterianas”.
Faltaban datos en niños
Aunque ya se sabía que la prescripción diferida de antibióticos para infecciones respiratorias funciona en adultos y había también algunos pocos datos en población pediátrica, Alonso y Mas-Dalmau reconocen que “os estudios que habían evaluado la prescripción diferida en infecciones respiratorias en población pediátrica eran escasos y, además, se habían realizado principalmente en Estados Unidos e Inglaterra”. Por tanto, añaden que los efectos de esta estrategia en países con un alto consumo de antibióticos, como ocurre en España y otros países del sur de Europa, no se conocían adecuadamente. “Nos interesaba saber cómo funcionaba en España y cómo reaccionaría nuestra población en términos de satisfacción y de creencia en el consumo de antibióticos”.
#Rectocolite hémorragique (RCH): mise à disposition de Stelara®, 1er inhibiteur des interleukines 12 et 23
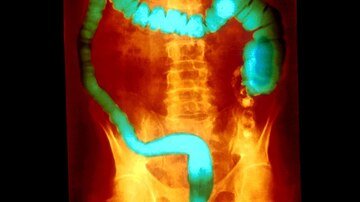
France — Après plusieurs indications en dermatologie et rhumatologie (psoriasis et rhumatisme psoriasique) depuis 2009 et une 1ère indication en gastro-entérologie avec la maladie de Crohn en 2018, Stelara® (ustekinumab, Janssen) est désormais disponible dans la rectocolite hémorragique [1].
Nouveau mécanisme dans la RCH
Stelara® est le premier inhibiteur d’interleukines (IL), ciblant les 12 et 23, à obtenir une autorisation de mise sur le marché dans la rectocolite hémorragique, une maladie inflammatoire chronique de l’intestin (MICI), dont souffrent à ce jour, 109 889 patients en France.
« Ce mécanisme d’action a déjà prouvé son efficacité dans les maladies inflammatoires chroniques telles que les maladies rhumatologiques et les maladies dermatologiques, note le Pr Laurent Peyrin-Biroulet, gastro-entérologue et hépatologue au CHRU de Nancy, dans le dossier de presse. Jusqu’à présent, nous disposions de 3 alternatives : les anti TNF alpha, les antiintégrines et les anti-JAK et c’est maintenant la première fois que nous pourrons utiliser un médicament agissant sur la voie de l’interleukine-23 pour le traitement de la RCH, alors que cette molécule est déjà disponible pour la maladie de Crohn depuis plusieurs années » précise-t-il.
UNIFI-I et UNIFI-M
L’efficacité et la tolérance de l’ustekinumab dans cette nouvelle indication ont été évaluées dans le cadre du programme pivotal de phase III UNIFI mené chez des patients ayant présenté une réponse inadéquate ou une intolérance aux traitements conventionnels (corticoïdes, immunomodulateurs) ou aux agents biologiques. La décision d’extension d’indication repose sur une étude d’induction (UNIFI-I) de huit semaines, suivie d’une étude d’entretien (UNIFI-M) de 44 semaines.
L’étude a inclus 961 patients et a été menée sur une durée de huit semaines durant laquelle les patients ont reçu une dose unique d’ustekinumab (dose recommandée d’environ 6 mg/kg ou dose fixe de 130 mg d’ustekinumab, qui n’est pas la dose retenue par l’AMM) ou de placebo par voie intraveineuse. 526 patients en réponse clinique à l’ustekinumab à l’issue de l’étude d’induction pouvaient être inclus dans l’étude d’entretien UNIFI-M où ils ont été randomisés pour recevoir soit 90 mg d’ustekinumab par voie sous-cutanée toutes les huit semaines, soit 90 mg d’ustekinumab par voie sous-cutanée toutes les douze semaines, soit un placebo pendant 44 semaines. Le critère d’évaluation principal de l’étude d’induction était la rémission clinique à la semaine 8 et celui de l’étude d’entretien était la rémission clinique à la semaine 44 chez les patients répondeurs à une perfusion IV unique d’ustekinumab lors de la phase d’induction[2].
Les études UNIFI-I et UNIFI-M ont démontré une efficacité clinique significative à 8 semaines et à 44 semaines versus placebo dans le traitement de la RCH active modérée à sévère, chez des patients adultes présentant une réponse insuffisante, une perte de réponse ou une intolérance à un traitement conventionnel ou à un agent biologique ou qui présentent une contre-indication médicale à ces traitements [2]. Environ 95% des patients en rémission étaient en rémission sans corticoïde à la semaine 44 [2].
Outre un maintien en général de l’efficacité du traitement au bout de 92 semaines, les données à deux ans démontrent aussi qu’environ >95% des patients en rémission symptomatique à S92 sont en rémission sans corticoïde[3].
Un profil de tolérance connu
Les données des études UNIFI-I et UNIFI-M mettent en évidence un profil de tolérance similaire par rapport au profil de tolérance déjà connu de l’ustekinumab qui est maintenant commercialisé depuis dix ans.
Les effets indésirables les plus fréquents (>5%) dans les phases contrôlées des études cliniques conduites avec l’ustekinumab chez les patients adultes atteints de psoriasis, de rhumatisme psoriasique, de la maladie de Crohn et de rectocolite hémorragique étaient des rhinopharyngites et des céphalées. La plupart ont été considérés comme étant légers et n’ont pas nécessité d’interruption du traitement étudié. Les effets indésirables les plus graves rapportés avec Stelara® sont des réactions d’hypersensibilité graves incluant l’anaphylaxie.
Stelara ® en pratique
Stelara® est indiqué dans le traitement de la rectocolite hémorragique active modérée à sévère chez les patients adultes en cas d’échec (réponse insuffisante, perte de réponse, intolérance ou contre-indication) des traitements conventionnels (5-aminosalicylés, corticoïdes et immunosuppresseurs) et d’au moins un médicament biologique parmi les anti- TNFα et le vedolizumab.
Dans la pratique, le traitement est initié par une dose unique en perfusion intraveineuse déterminée en fonction du poids corporel. La première dose sous-cutanée doit ensuite être administrée à la semaine 8 après la dose intraveineuse puis toutes les 12 semaines par voie sous-cutanée 16. Les patients recevant une administration toutes les 12 semaines et qui présentent un échappement après une réponse initiale peuvent bénéficier d’une augmentation de la fréquence d’administration à toutes les 8 semaines. Après une formation appropriée à la technique d’injection sous-cutanée, les patients peuvent s’injecter Stelara® si leur médecin l’estime approprié.
Actualités Medscape © 2021 WebMD, LLC
Citer cet article: Rectocolite hémorragique (RCH): mise à disposition de Stelara®, 1er inhibiteur des interleukines 12 et 23 – Medscape – 12 févr 2021.