ginecologia / obstetricia
Transição Menopausal: como prevenir doenças cardiovasculares?
As doenças cardiovasculares, como AVC e doenças isquêmicas cardíacas, são as recordistas de causas mortis no mundo. Desde 2011, a Associação Americana de Cardiologia tem orientado para que olhemos com maior atenção para algumas particularidades relacionadas à transição menopausal, momento particularmente frágil, mas importante, para iniciar a prevenção dos agravos cardiovasculares na saúde feminina.
No final de 2020, um artigo interessante publicado no periódico Circulation apontou alguns dados relevantes para serem observados, em particular nessa população de mulheres:

Dados sobre a transição menopausal
- Transição da menopausa é um momento de aumento de risco cardiovascular para a mulher.
- Algumas doenças endócrinas e metabólicas estão intimamente ligadas a essa época, sendo fatores de piora de prognóstico.
- A ligação entre transição menopausal e doença cardiovascular é bidirecional.
- A transição para menopausa traz piora do perfil metabólico para a mulher, independente da época em que ocorra.
- Diabetes é um fator de risco para doenças cardiovasculares, tanto em homens como em mulheres. Sua prevalência aumentada está associada ao status menopausal na mulher.
- Ainda não existem estratégias preventivas efetivas, (como mudança do estilo de vida) que sejam específicas para essas mulheres nesse período.
- As terapias hipolipemiantes nunca se mostraram eficazes na prevenção primária de doenças cardiovasculares em mulheres e até mesmo as evidências sobre a prevenção secundária são escassas.
- A terapia hormonal da menopausa (iniciada em mulheres com menos de 60 anos ou dentro de 10 anos da menopausa para aliviar os sintomas da menopausa e prevenir ou tratar a osteoporose) é atualmente a única intervenção que diminui o risco de doença cardiovascular e diabetes em mulheres saudáveis na meia idade.
Assim sendo, torna-se importante dentro das estratégias de atenção à saúde da mulher, atenção a esse período muitas vezes desassistido por algumas mulheres apresentarem poucos sintomas. Torna-se mister a orientação para tratamento e prevenção dos eventos cardiovasculares na atenção primária na saúde da mulher.
Autor:
João Marcelo Martins Coluna
Médico Ginecologista e Obstetra formado pela Universidade Estadual de Londrina • Mestrado em Fisiopatologia pela Unoeste (Universidade Oeste Paulista) • Docente da Unoeste (Presidente Prudente) – departamento materno infantil • Preceptor Residência Médica Hospital Regional Presidente Prudente – SP • Plantonista Ginecologia e Obstetrícia Hospital Regional Presidente Prudente • Plantonista Ginecologia e Obstetrícia Hospital Estadual Dr. Odilo Antunes Siqueira (Presidente Prudente – SP) • Plantonista Ginecologia e Obstetrícia Santa Casa de Misericórdia de Adamantina
Plantonista Socorrista Santa Casa de Misericórdia Presidente Prudente • Médico Regulador ambulatorial município de Dracena – SP • Médico Preceptor ambulatorial UNIFADRA (Dracena – SP) • Ginecologista do serviço ambulatorial de Narandiba (SP) • Ginecologista e Obstetra do serviço ambulatorial de Pirapozinho (SP).
Referência bibliográfica:
- Nappi, Rossella E e Simoncini, Tommaso. https://www.thelancet.com/journals/landia/article/PIIS2213-8587(21)00018-8/fulltext
Ingestão de vitamina B12 pré-natal materna e desenvolvimento na infância
As deficiências de muitos nutrientes na gravidez têm efeitos adversos no desenvolvimento do cérebro do feto, com consequente comprometimento da função cognitiva na infância. Alguns estudos já demostraram de forma muito clara efeitos adversos identificáveis no nascimento para crianças nascidas de mulheres com deficiências vitamínicas, como por exemplo, parto prematuro e defeitos do tubo neural.
Estamos em um momento em que o vegetarianismo e o veganismo estão se tornando mais populares, e as mulheres que possuem esse hábito podem ter sua dieta inadequada em nutrientes como a vitamina B12. No entanto, não está claro se a deficiência dessa vitamina no período pré-natal é prejudicial ao feto.
O desenvolvimento do cérebro é mais rápido nos primeiros anos de vida, o que pode torná-lo mais vulnerável a deficiências nutricionais. Alguns estudos sobre neurodesenvolvimento observaram que bebês com atrofia cerebral e desmielinização de células nervosas, ao receberem vitamina B12 responderam de forma surpreendente, apresentando uma rápida melhora nos sintomas neurológicos.

Novas evidências
No dia 30 de dezembro de 2020, a revista Nutrition Research publicou um estudo realizado no Reino Unido correlacionando a ingesta de vitamina B12 na gestação com o desenvolvimento cognitivo infantil.
O estudo selecionou aproximadamente 10 mil gestantes e seus filhos. As mães, na trigésima segunda semana de gestação, respondiam um questionário que detalhava sua alimentação e calculava dessa forma a quantidade de vitamina B12 ingerida. Aos 8 anos de idade, os filhos destas pacientes passavam por uma avaliação cognitiva, que incluíam testes de fala e linguagem, soletração, leitura, matemática e ciências e QI.
Resultados
O trabalho evidenciou que os filhos de pacientes com o menor consumo de B12 estavam em maior risco de vocabulário pobre aos 24 meses, capacidade reduzida de combinar palavras aos 38 meses, baixa inteligibilidade de fala aos 6 anos, baixa compreensão de matemática no quarto e sexto anos (idades de 8-9 e 10-11 anos) e resultados insatisfatórios nos testes nacionais de matemática (13 anos). Não houve tais associações ajustadas significativas para habilidades de leitura ou ortografia, ou para QI verbal ou de escala total (quociente de inteligência) em 8 ou em 15.
Pontos fracos do estudo
O estudo não avaliou pacientes com ingesta muito limitada de Vitamina B12, que pode ocorrer por exemplo em países subdesenvolvidos, bem como não foi avaliada a ingesta da vitamina no início da gestação. Além disso, pacientes com baixa ingesta de vitamina B12 também podem ter outras carências nutricionais, o que gera um fator de confundimento.
Conclusão
Dessa forma, observamos que existem efeitos adversos no desenvolvimento da criança se a gestante tiver uma baixa ingestão de vitamina B12, principalmente para certas habilidades matemáticas e de fala.
Autor(a):
Juliana Olivieri
Graduada em Medicina pela Universidade Federal do Rio de Janeiro (UFRJ) ⦁ Ginecologista e Obstetra ⦁ Pós-graduada em Endocrinologia Feminina e Climatério pelo Instituto Nacional de Saúde da Mulher da Criança e do Adolescente Fernandes Figueira(IFF/Fiocruz)
Referências bibliográficas:
- Jean Golding, Steven Gregory, Rosie Clark, Yasmin Iles-Caven, Genette Ellis, Caroline M. Taylor, Joseph Hibbeln, Maternal prenatal vitamin B12 intake is associated with speech development and mathematical abilities in childhood. Nutrition Research. 2021;86:68-78. doi: 10.1016/j.nutres.2020.12.005.
Novo caminho para a estimativa de risco de #câncer de mama na população geral

Novos achados de mutações genéticas no câncer de mama em mulheres sem história familiar da doença abrem um novo caminho para a estimativa de risco e podem modificar a forma como essa população é orientada.
Os achados são provenientes de dois grandes estudos, ambos publicados em 20 de janeiro no periódico The New England Journal of Medicine.
Os dois artigos são “extraordinários” por ampliarem e validarem o painel genômico como forma de contribuir para o rastreamento de mulheres com risco de câncer de mama, comentou o Dr. Eric Topol, médico, professor de medicina molecular, Scripps Research, nos Estados Unidos, e editor chefe do Medscape.
“Tradicionalmente, os exames genéticos para identificar genes hereditários do câncer de mama são focados em mulheres de alto risco que apresentam importante história familiar de câncer de mama ou nas que foram diagnosticadas ainda jovens, por exemplo, antes dos 45 anos”, comentou o primeiro pesquisador de um dos estudos, Dr. Fergus Couch, Ph.D., patologista na Mayo Clinic, nos EUA.
“Embora o risco de câncer de mama geralmente seja menor para mulheres sem história familiar da doença (…) ao avaliarmos todas as mulheres nós descobrimos que 30% das mutações do câncer de mama ocorreram nas que não apresentavam alto risco”, explicou o pesquisador.
Em ambos os estudos, oito genes (BRCA1, BRCA2, PALB2, BARD1, RAD51C, RAD51D, ATM e CHEK2)apresentaram mutações ou variantes significativamente associadas a risco de câncer de mama.
No entanto, a distribuição das mutações entre mulheres com câncer de mama diferiu da distribuição entre mulheres sem diagnóstico de câncer, observou o Dr. Steven Narod, médico do Women’s College Research Institute, no Canadá, em um editorial que acompanhou a publicação.
“Para os médicos, isso significa que agora que estamos expandindo o uso do painel genético para incluir mulheres sem diagnóstico de câncer de mama com risco moderado de desenvolver a doença no que tange a história familiar, passaremos mais tempo orientando mulheres com mutações CHEK2 e ATM“, escreveu. Hoje em dia, esses dois genes “são agrupados aos demais (…) A maior parte da discussão pré-teste atualmente está focada nas implicações de encontrar uma mutação BRCA1 ou BRCA2.“
Segundo o Dr. Steven, os novos achados podem levar a novas estratégias de manejo de risco. “A maioria dos tumores de mama em mulheres com mutação no ATM ou CHEK2 são positivos para receptores de estrogênio, então essas mulheres podem ser candidatas a terapias antiestrogênicas como tamoxifeno, raloxifeno ou inibidores de aromatase”, escreveu.
O Dr. Steven observou que, por ora, o acompanhamento da maioria das mulheres com qualquer uma das mutações vai consistir apenas em rastreamento, começando com ressonância magnética (RM) aos 40 anos.
A comunidade médica ainda não está pronta para expandir o rastreamento genético para a população em geral, alertou o Dr. Walton Taylor, médico e ex-presidente da American Society of Breast Surgeons (ASBrS).
A ASBrS atualmente recomenda que todas as pacientes com câncer de mama, assim como aquelas em alto risco de desenvolver a doença, realizem os exames genéticos. “Todas as mulheres em risco devem ser testadas, e todas as pacientes com variantes patogênicas precisam ser tratadas adequadamente – isso salva vidas”, enfatizou o Dr. Walton.
No entanto, “pessoas sem diagnóstico de câncer e sem história familiar não precisam de exames genéticos nesse momento”, ele disse ao Medscape.
Quanto ao que os médicos podem fazer para cuidar melhor de pacientes com mutações que predispõem ao câncer de mama, o Dr. Walton disse que “é surpreendentemente simples”.
Todos os laboratórios genéticos têm pessoas que realizam o aconselhamento genético para orientar os próximos passos das pacientes, apontou o Dr. Walton, e [nos EUA,] a maioria dos pacientes com câncer é assistida por enfermeiras treinadas para esse tipo de orientação, que se certificam que esses pacientes sejam devidamente testados e acompanhados.
Os membros da ASBrS seguem as diretrizes da National Comprehensive Cancer Network quando identificam portadoras de uma variante patogênica. O Dr. Walton disse que essas diretrizes são muito úteis para virtualmente todas as mutações identificadas até agora.
“Essa pesquisa não é necessariamente nova, mas atesta o que estamos fazendo, e isso contribui para sabermos que estamos seguindo o caminho certo”, disse o Dr. Walton. O trabalho “confirma que o que achamos que está certo, está realmente certo — e isso importa”, afirmou.
Achados do consórcio CARRIERS
O estudo, liderado pela equipe da Mayo Clinic e conduzido pelo consórcio Cancer Risk Estimates Related to Susceptibility (CARRIERS), realizou a análise de dados de 17 estudos epidemiológicos avaliando mulheres na população em geral que tiveram câncer de mama. Para o estudo, que foram realizados nos Estados Unidos, foram sequenciadas variantes patogênicas de 28 genes que predispõem ao câncer em 32.247 pacientes com câncer de mama (casos) e em 32.544 mulheres sem diagnóstico da doença (controles).
Na análise global do CARRIERS, a prevalência de variantes patogênicas em 12 genes clinicamente acionáveis foi de 5,03% entre os casos e de 1,63% entre os controles. A prevalência foi semelhante em mulheres brancas não hispânicas e negras não hispânicas e hispânicas, tanto entre os casos quanto entre os controles. A prevalência entre pacientes de descendência asiática foi menor, de apenas 1,64%, observaram.
Dentre pacientes que tiveram câncer de mama, as variantes patogênicas mais comuns incluíram BRCA2 (1,29% dos casos), seguida pela CHEK2 (1,08%) e BRCA1 (0,85%).
As mutações no BRCA1 aumentaram o risco de câncer de mama em mais de 7,5 vezes, e as mutações no BRCA2 aumentaram esse risco em mais de cinco vezes, observam os pesquisadores.
As mutações no PALB2 aumentaram o risco de câncer de mama em aproximadamente quatro vezes, acrescentam.
As taxas de prevalência de BRCA1 e BRCA2 para entre pacientes com câncer de mama declinaram rapidamente após a idade de 40 anos. O declínio de outras variantes, incluindo ATM, CHEK2 e PALB2, foi limitado com o aumento da idade.
Assim, mutações nesses cinco genes foram associadas a um risco absoluto de câncer de mama ao longo da vida > 20% até os 85 anos de idade entre brancas não hispânicas.
As variantes patogênicas no BRCA1 ou BRCA2 levaram a um risco ao longo da vida de câncer de mama de aproximadamente 50%. As mutações no PALB2 levaram a um risco da doença ao longo da vida de cerca de 32%.
O risco de mutação em genes específicos variou de acordo com o tipo de câncer de mama. Por exemplo, mutações nos genes BARD1, RAD51C e RAD51d aumentaram o risco de câncer de mama negativo para o receptor de estrogênio, assim como de câncer de mama triplo negativo, observaram os autores, enquanto as mutações nos genes ATM, CDH1 e CHEK2 aumentaram o risco de câncer de mama positivo para o receptor de estrogênio.
“Essas estimativas refinadas das prevalências das variantes patogênicas entre mulheres com câncer de mama na população em geral, em oposição a pacientes de alto risco específicas, podem informar discussões futuras a respeito de exames em pacientes com câncer de mama”, observaram os autores do Breast Cancer Association Consortium (BCAC).
“Os riscos de câncer de mama associados a variantes patogênicas nos genes avaliados na análise de base populacional CARRIERS também fornecem informações importantes para a avaliação do risco e o aconselhamento de mulheres com câncer de mama que não têm critérios de seleção para alto risco”, sugeriram.
Achados similares no segundo estudo
O segundo estudo foi conduzido pelo BCAC sob a liderança da Dra. Leila Dorling, Ph.D., University of Cambridge, no Reino Unido. Esse grupo sequenciou 34 genes de susceptibilidade de 60.466 mulheres com câncer de mama e 53.461 controles sem diagnóstico de câncer.
“Variantes com proteínas truncadas em cinco genes (ATM, BRCA1, BRCA2, CHEK2 e PALB2) foram associadas com um risco significativo de câncer de mama em geral (P < 0,0001)”, relataram os membros do BCAC. “Para esses genes, a razão de chances variou de 2,10 a 10,57”, acrescentaram.
A associação entre o risco geral de câncer de mama e as mutações em sete outros genes foi mais discreta, conferindo aproximadamente o dobro do risco de câncer de mama em geral, embora esse risco seja três vezes maior para mutações do TP53.
Para os 12 genes que o consórcio destacou como estando associados ou a um risco significativo ou mais discreto de câncer de mama, o tamanho do efeito não variou significativamente entre mulheres europeias e asiáticas, observaram os autores. Novamente, o risco de câncer de mama positivo para o receptor de estrogênio foi mais de duas vezes maior para aquelas que tinham mutações no ATM ou CHEK2. Ter mutações no BARD1, BRCA1, BRCA1, PALB2, RAD51C, e RAD51D conferiu maior risco de doença negativa para o receptor de estrogênio do que de doença positiva.
Também houve uma associação entre raras variantes com perda de sentido em seis genes (CHEK2, ATM, TP53, BRCA1, CDH1 e RECQL) e risco de câncer de mama em geral, com evidências mais claras para o CHEK2.
“O risco absoluto estimado coloca as variantes com proteína truncada dos genes BRCA1, BRCA2 e PALB2 na categoria de alto risco, e as variantes com proteína truncada dos genes ATM, BARD1, CHEK2, RAD51CC e RAD51D na categoria de risco moderado”, afirmaram a Dra. Leila e colaboradores.
“Esses resultados podem guiar o rastreamento, assim como a prevenção, com redução do risco de cirurgia ou de uso de medicamentos, de acordo com diretrizes nacionais”, sugeriram os autores.
O estudo CARRIERS foi financiado pelos National Institutes of Health. O estudo da Dra. Leila e colaboradores foi financiado por programas de pesquisa e inovação da European Union Horizon 2020, entre outros. O Dr. Steven informou não ter conflitos de interesses.
New Eng J Med. Publicado on-line em 20 de janeiro de 2021. Couch et al, Abstract ; Estudo do BCAC, Texto completo; Editorial
Medscape Notícias Médicas © 2021 WebMD, LLC
Citar este artigo: Novo caminho para a estimativa de risco de câncer de mama na população geral – Medscape – 11 de fevereiro de 2021.
Covid-19 durante a gestação pode aumentar risco de hipertensão e pré-eclâmpsia

Dra. Nigel Madden
“Isso não foi totalmente surpreendente, visto que a inflamação vem sendo implicada na patogênese tanto da doença hipertensiva gestacional como da infecção por SARS-CoV-2, portanto, uma pode exacerbar a outra”, a Dra. Nigel Madden, médica residente no Departamento de Ginecologia e Obstetrícia da Columbia University, nos Estados Unidos, disse ao Medscape após apresentar os resultados.
A doença hipertensiva gestacional ocorre em 10% a 15% de todas as gestações e representa a principal causa de morbidade e mortalidade materna e perinatal do mundo, explicou a Dra. Nigel aos participantes do encontro. Embora não esteja claro o que causa as doenças hipertensivas na gestação, de forma geral, “é possível que o estado inflamatório agudo da infecção por SARS-CoV-2 possa incitar ou exacerbar a doença hipertensiva gestacional”, comentou a Dra. Nigel.
Os pesquisadores conduziram uma revisão retrospectiva de prontuários de 1.715 pacientes que tiveram gestação única e que foram submetidas a exame por reação em cadeia da polimerase (PCR, sigla do inglês, Polymerase Chain Reaction), a partir de amostra nasofaríngea, no momento da admissão hospitalar na instituição na qual realizaram o trabalho de parto, entre março e junho de 2020. Os pesquisadores excluíram pacientes com história de hipertensão crônica.
No total, 10% das pacientes apresentaram resultado positivo para covid-19 (N = 167) e 90% apresentaram resultado negativo (N = 1.548). Houve várias diferenças basais entre os grupos. As pacientes com resultado positivo tenderam a ser mais jovens; média de idade de 28 anos versus 31 anos para as pacientes com resultado positivo. A proporção de pacientes acima de 35 anos de idade também foi maior no grupo negativo (P < 0,01). Houve diferenças significativas na composição racial dos grupos; metade do grupo positivo referiu “outras” ao indicar a própria raça. A maior disparidade basal entre os grupos foi em relação ao seguro de saúde: 73% das pacientes com resultado positivo para covid-19 usavam o Medicaid, enquanto apenas 36% das pacientes no grupo negativo para covid-19 usavam esse recurso. As que tinham plano de saúde particular foram mais propensas a apresentar resultado negativo (43%) do que positivo (25%) (P < 0,01).
Os pesquisadores definiram hipertensão gestacional como pressão sistólica ≥ 140 mmHg ou pressão diastólica ≥ 90 mmHg em duas aferições com no mínimo quatro horas de intervalo. O diagnóstico de pré-eclâmpsia exigiu pressão arterial elevada (mesmos critérios usados para definir hipertensão), além de proteinúria, caracterizada por razão proteína/creatinina ≥ 0,3 mg/dL ou proteína ≥ 300 mg na urina de 24 horas. A pré-eclâmpsia grave exigiu alterações laboratoriais específicas, edema pulmonar, sintomas de cefaleia, alterações visuais, dor torácica, dispneia ou dor no quadrante superior direito
Em relação à doença hipertensiva gestacional, a ocorrência da doença foi mais do que duas vezes maior entre as pacientes com covid-19 (17,9%) em comparação com as pacientes que apresentaram resultado negativo (8,4%). O grupo positivo para covid-19 teve probabilidade significativamente maior de apresentar hipertensão gestacional e pré-eclâmpsia sem características de gravidade do que o grupo negativo para covid-19. As taxas de pré-eclâmpsia com características de gravidade não foram significativamente diferentes entre os grupos.
| Negativas para covid-19 | Positivas para covid-19 | Valor de P | |
|---|---|---|---|
| Hipertensão gestacional | 3,6% | 9,0% | < 0,001 |
| Pré-eclâmpsia | 1,3% | 3,6% | 0,03 |
| Pré-eclâmpsia grave | 3,6% | 5,4% | 0,12 |
A gravidade da doença hipertensiva não diferiu entre os grupos. As limitações do estudo incluíram o fato de o desenho ter sido retrospectivo, o pequeno número de pacientes positivas para covid-19 e o estudo ter sido conduzido em uma única instituição na cidade de Nova York, nos EUA. No entanto, a população do estudo era diversificada e a pesquisa foi realizada durante o pico de infecções no epicentro da pandemia de covid-19.
“Esse foi um estudo de grande significado clínico”, disse a Dra. Kim Boggess, médica da University of North Carolina, nos EUA, enquanto moderava a sessão. “Eu diria vocês de Nova York são os mais bem posicionados para responder a algumas questões que precisam ser respondidas a respeito do efeito da infecção pelo coronavírus na gestação”.
A Dra. Kim perguntou se o estudo avaliou associações relacionadas com a gravidade da covid-19. Apenas 10 pacientes eram sintomáticas, disse a Dra. Nigel, e apenas uma apresentou pré-eclâmpsia com características de gravidade.
A Dra. Michelle Y. Owens, médica, professora e chefe de medicina materno-fetal no University of Mississippi Medical Center, nos EUA, que também moderou a sessão, disse que os achados requerem que os médicos atentem para a possibilidade de hipertensão e transtornos hipertensivos ao atenderem pacientes positivas para covid-19.
“Além disso, essas mulheres deveriam ser instruídas em relação aos transtornos hipertensivos e sintomas comuns, a fim de facilitar o diagnóstico precoce e o tratamento, quando indicado”, disse a Dra. Michelle. “Eu acredito que isso é de particular interesse para as mulheres que não são gravemente afetadas pela covid-19, na medida em que essas alterações podem ocorrer enquanto elas estiverem em quarentena ou sendo monitoradas remotamente. Isso aumenta a necessidade de avaliação remota ou monitoramento domiciliar da pressão arterial materna.”
As Dras. Nigel, Kim e Michelle informaram não ter conflitos de interesses.
Encontro anual de 2021 da Society for Maternal-Fetal Medicine (SMFM): Abstract 32. Apresentado em 28 de janeiro de 2021.
Medscape Notícias Médicas © 2021 WebMD, LLC
Citar este artigo: Covid-19 durante a gestação pode aumentar risco de hipertensão e pré-eclâmpsia – Medscape – 9 de fevereiro de 2021.
Descoberto novo mecanismo fisiopatológico da pré-eclâmpsia
A pré-eclâmpsia é clinicamente caracterizada na segunda metade da gravidez por novo início de hipertensão associado à proteinúria ou disfunção orgânica materna, ou disfunção útero-placentária. A prevalência da doença é 4-5% nas gestações e é uma das principais causas de morbidade e mortalidade materna e fetal no mundo inteiro, frequentemente complicando com a restrição do crescimento fetal e prematuridade.
Além disso pré-eclâmpsia é considerada também um sinal de alerta a longo prazo para doença cardiovascular (DCV) mais tarde na vida da mulher. Os mecanismos fisiopatológicos são incansavelmente estudados há anos, mas ainda não são totalmente esclarecidos.

Pregnant belly of young woman during regular examination at hospital
Novas evidências
Um estudo norueguês, publicado na revista americana Frontiers no fim de 2020, pesquisou um novo elo de associação entre as fisiopatologias da DCV e da pré eclampsia: a ativação do inflamassoma de NLRP3 mediada por cristais de colesterol.
O estudo teve como objetivo primário investigar o acúmulo de cristais de colesterol e a expressão do inflamassoma NLRP3 por células maternas e fetais na decídua da parede uterina de gestações normais e de gestações pré-eclâmpticas com e sem restrição de crescimento fetal.
Primeiro trabalho a revelar a presença de cristais de colesterol na interface materno-fetal na decídua da parede uterina
Observou-se uma resposta do inflamassoma de NLRP3 mediada por cristais de colesterol como um importante mecanismo inflamatório associado à interação materno-fetal na decídua da parede uterina na gravidez.
Os cristais de colesterol foram detectados em grande quantidade na decídua, e a expressão da via inflamatória NLRP3 mostrou ser um dos pontos centrais para interação próxima entre trofoblastos do bebê e leucócitos maternos. Tanto os trofoblastos quanto os leucócitos são equipados com receptores que permitem a captação de colesterol.
Além disso, foi observada a formação de placas de ateroma nas artérias uterinas, uma malformação vascular que lembra a aterosclerose em estágio inicial.
Cristais de colesterol em regiões específicas da decídua
O trabalho observou que as células contendo cristais de colesterol pareciam agregadas no tecido decídua, em vez de dispersas aleatoriamente, sugerindo que a inflamação mediada por cristais de colesterol pode estar localizada em regiões específicas da decídua.
A pré-eclâmpsia com crescimento fetal normal foi associada à expressão aumentada de NLRP3, particularmente em áreas deciduais de interação materno-fetal próxima, sugerindo que esse perfil pró-inflamatório aumentado desempenha um papel em estágios mais finais da patologia da pré-eclâmpsia.
A identificação de cristais de colesterol decidual e expressão aumentada de inflamassoma de NLRP3 decidual em pré-eclâmpsia com crescimento fetal normal confirma ainda mais a ligação fisiopatológica entre pré-eclâmpsia e DCV.
Conclusão
Este estudo elucidou um novo mecanismo fisiopatológico envolvido na pré-eclampsia e que a investigação combinada de mecanismos patológicos específicos de células nos dois locais da interface materno-fetal pode fornecer um conhecimento mais abrangente da regulação e importância da comunicação materno-fetal.
Estatinas e anti-inflamatórios na pré eclampsia
A pravastatina, usada para tratamento de dislipidemia e prevenção de DCV, é um possível candidato para tratar e prevenir a pré-eclâmpsia. As estatinas podem melhorar as principais respostas patológicas envolvidas na pré-eclâmpsia, incluindo a inibição da liberação de sFlt-1 e redução da inflamação e estresse oxidativo. Além do mais, podem inibir a formação e melhorar a solubilidade dos cristais de colesterol em placas ateroscleróticas.
É necessária investigação adicional para demonstrar se um efeito positivo da pravastatina na pré-eclâmpsia pode envolver a remoção de cristais de colesterol nessa interface materno-fetal.
Por último, cada vez mais surgem evidências que apoiam os benefícios dos anti-inflamatórios que agem especificamente no inflamassoma NLRP3, porém, se eles são seguros para gravidez e eficazes na pré-eclâmpsia, isso ainda precisa ser determinado.
Autor(a):
Juliana Olivieri
Graduada em Medicina pela Universidade Federal do Rio de Janeiro (UFRJ) ⦁ Ginecologista e Obstetra ⦁ Pós-graduada em Endocrinologia Feminina e Climatério pelo Instituto Nacional de Saúde da Mulher da Criança e do Adolescente Fernandes Figueira(IFF/Fiocruz)
Referências bibliográficas:
- Brettas SG, Marijn GL, Johnsen RJ, Sannerud SG, Boon MS, Josefin TA, Bjørnar S, Mattijs E, Karin C, Line B, Hjelmseth AM, Vestrheim TLC, Ann-Charlotte I. Cholesterol Crystals and NLRP3 Mediated Inflammation in the Uterine Wall Decidua in Normal and Preeclamptic Pregnancies. Frontiers in Immunology. 2020 Oct 8;11:564712. doi: 3389/fimmu.2020.564712
Câncer de Mama em Adolescentes e Adultas Jovens (AAJs), o que há de novo?
Nos EUA, uma em cada 196 mulheres vai receber o diagnóstico de câncer de mama (CM) abaixo dos 40 anos. Adolescentes e Adultas Jovens (AAJs), com 15-39 anos experimentam inúmeros desafios com o diagnóstico de CM. A incidência nos EUA vem aumentando desde 2004 e, infelizmente, muitas são diagnosticadas em estágios avançados. AAJ têm maior probabilidade de apresentarem histologias mais agressivas, doença localmente avançada e já necessitarem de tratamento sistêmico no diagnóstico. AAJ têm ainda maior probabilidade de serem carreadoras de mutações germinativas, o que indica aconselhamento precoce para ajudar na tomada de decisão sobre tratamentos locais por exemplo. Oncologistas devem se engajar em grupos multidisciplinares para prover cuidado otimizado para estas jovens, incluindo, quando possível, avaliação com fertileuta, aconselhamento genético, apoio nutricional, psicológico, fisioterápico, entre outras especificidades.

O CM – não parece – mas é o tipo de câncer mais comum em mulheres entre 15-39 anos nos EUA, sendo responsável por 30% dos casos. De acordo com dados do SEER, 5,6% de todos os casos de CM invasivo ocorrem em AAJs. Estima-se que 12 mil casos tenham sido diagnosticados nos EUA, neste grupo, em 2020. Infelizmente, mesmo em estágios iniciais, o risco de morte é 39% maior que outras mulheres com o mesmo estágio. Some-se a isso a maior possibilidade de eventos adversos com a terapia e o maior impacto psicossocial para entender a magnitude do problema.

CM em AAJs
Metade das AAJs com CM apresentam uma mutação germinativa, em especial BRCA1, BRCA2, ou TP53. Destas 16,9% apresentam variantes que tem impacto na decisão cirúrgica, contra 10% em mulheres mais velhas. Como o teste genético demora em média 2-3 semanas para ficar pronto, quanto antes for testada, melhor. Isso pode ser especialmente importante para portadoras de BRCA1/2, PALB2, TP53 e outras mutações com possível indicação de adenectomia redutora de risco contralateral. AAJs portadoras de mutação de TP53 podem realizar mastectomia em função do risco aumentado de câncer induzido por radiação nesta variante. TP53 é de especial importância no Brasil, em especial no sul e sudeste.
Fatores hormonais também “pesam” em aumentar o risco, como menarca precoce, contraceptivos orais, infertilidade anovulatória, primeira gestação após 30 anos. Amamentação também reduz risco nesta faixa etária, e história prévia de irradiação de mediastino na infância ou cedo na adolescência aumenta muito o risco.
AAJs tem 9 vezes maior risco de recidiva local após cirurgia conservadora, e isso se deve a diferenças na biologia. Apesar deste risco aumentado, este não é um argumento suficiente para oferecer cirurgias radicais para todas as mulheres jovens. Vários pontos entram nesta “equação”, como sexualidade, fertilidade, impacto na imagem corporal, daí a importância do “time multidisciplinar” no cuidado destas pacientes. Não raro, considerando também a simetria com a mama oposta, muitas pacientes jovens optam por mastectomia bilateral com reconstrução em detrimento de cirurgias mais conservadoras. Evidente que aquela mulher jovem que deseja amamentar deve focar no tratamento da mama acometida.
CM em AAJs frequentemente tem características de alto risco, como receptores hormonais negativos, alto grau, HER2 enriquecido, invasão vascular e linfática. Mesmo com os avanços do tratamento sistêmico a sobrevida é menor, estágio por estágio, quando comparada com mulheres com mais idade. Apesar destes pontos, o benefício de quimioterapia (neo) adjuvante é similar, não importa a idade. Infelizmente ainda são poucos os estudos clínicos focados nesta população ou mesmo a participação em outros é baixa. Em linhas gerais, o tratamento oncológico é similar, não importa a idade, mas o limiar para a inclusão de derivados de platina (e imunoterapia*) na quimio pré-operatória, na decisão de realizá-la é menor entre AAJs, em especial entre os casos triplo negativos e portadores da expressão de HER2.
Com relação aos tumores RH positivos e o uso de testes genômicos em caráter adjuvante para indicação de quimio (Oncotype DX ou MammaPrint), é mais difícil entender o real benefício de QT adjuvante com escores intermediários, em especial com ODX entre 21-25, mas também entre 16-20, pois pode haver benefício de quimio da ordem de 5-10%. Talvez o principal benefício seja da supressão ovariana, que frequentemente ocorre com a QT. Por isso, em mulheres jovens, a adição de supressão ovariana ao uso de um inibidor da aromatase pode promover uma redução de risco de recidiva de 10-15% em pacientes de alto risco, sem quimio! Precisamos de mais dados em pacientes AAJs para determinar o real papel destes testes genômicos. O tratamento adjuvante endócrino ainda é o standard of care para estas mulheres, por reduzir o risco de recorrência em 50% e este risco pode ser ainda menor se incluirmos a supressão ovariana, mas nem todas toleram este “duplo bloqueio”, devido ao maior ressecamento vaginal, disfunção sexual, fogachos etc. Portanto, em pacientes de menor risco, a supressão ovariana frequentemente não é uma opção. A duração em geral pode chegar aos dez anos de tamoxifeno, pois a adjuvância estendida reduz ainda mais o risco. Não temos estudos de supressão ovariana por tanto tempo. Em AAJs onde fertilidade não é uma questão, salpingo-ooforectomia bilateral pode ser uma opção em especial para mulheres portadoras de BRCA1, BRCA2, BRIP1, RAD51C/D, e de genes da Síndrome de Lynch às injeções mensais ou trimestrais de análogos de LHRH.
Uma questão muito especial neste grupo é a preservação de fertilidade, já que QT pode causar infertilidade. Menopausa prematura pode ocorrer em 13% das pacientes que recebem QT, podendo chegar a mais de 60% quanto mais perto dos 40 anos. Criopreservação de embriões e de oócitos são estratégias efetivas, mas o acesso é difícil e o custo é alto. De qualquer forma, referir para o fertileuta sempre que possível é fundamental. Como alternativa, análogos LHRH durante a QT para reduzir o risco de infertilidade, com o dobro de chance de uma AAJs conseguir engravidar em caso de uso de análogo. É considerado experimental interromper o tratamento endócrino para permitir uma gravidez nestas pacientes. Um estudo, o POSITIVE TRIAL está avaliando o risco desta interrupção mais precoce, entre 18-30 meses de tratamento.
Devemos reforçar o uso de contraceptivos não hormonais, em especial o DIU de cobre e são muitas as questões relevantes entre as pacientes que estão em seguimento de longo prazo como a cardiotoxicidade relacionada à QT, o risco de fraturas por osteoporose em pacientes com menopausa precoce ou química prolongada. Muitas questões psicossociais são mais frequentes nesta população como depressão, ansiedade, isolamento, imagem corporal deteriorada, perda de relações pessoais, limitações físicas ocupacionais, e toxicidade financeira…tudo isso precisa de atenção e cuidado.

E no Brasil?
Sabemos que não há diretriz de rastreamento para esta população, que mamografia tem baixo rendimento em mamas jovens e densas e não raro quando há o diagnóstico de CM o estágio é mais avançado. Pesquisadores brasileiros publicaram recentemente um levantamento retrospectivo com dados de um grande hospital universitário de SP, nesta população de mulheres com CM e menos de 45 anos2, e compararam seus achados com outros três bancos de dados, sendo um americano. Num total de 101 mil casos avaliados da Fundação Oncocentro de SP, 4,4% tinham menos de 35 anos (10% <40 anos), 20% < 45 anos (muito semelhante aos dados do INCA), contra 1,85% e 11,5% no banco de dados do SEER americano, respectivamente. O estagiamento também é mais avançado por aqui…45% doença localmente avançada e 10% estágio IV, contra 29% e 6% nos EUA…mais pacientes tinham tumores maiores e/ou com comprometimento linfonodal. Como esperado, mais pacientes com tumores luminais B, triplo negativos, HER2 superexpresso, menos casos de luminais A, o que leva a um prognóstico mais reservado.
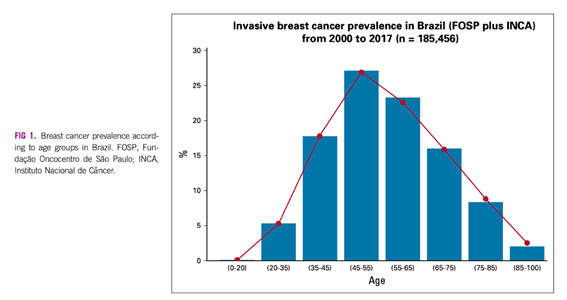

Como deu para notar, a prevalência do CM em mulheres com menos de 40 anos no Brasil não é irrelevante. Se são 10% dos casos, estamos falando de 7000 casos novos ao ano, mais do que muitas neoplasias primárias. Cabe destacar que nossa incidência é maior neste sub-grupo que nos EUA, como já foi demonstrado em outros países em desenvolvimento. Pode estar relacionado à nossa ainda jovem pirâmide populacional, mas outros fatores podem estar relacionados, como consumo de álcool e tabaco, questões hormonais (como já descrito) e outros carcinógenos, como pesticidas organoclorados e diferentes disrruptores endócrinos, como o bisfenol A. O fato é que o Brasil é um dos maiores consumidores de agrotóxicos e de plásticos do mundo. Mais estudos de exposição à carcinógenos e a estes disrruptores são necessários.
Os pesquisadores brasileiros reforçam o conceito de que essas mulheres jovens são diagnosticadas em estágios mais avançados, com cânceres de mama de histologia e imunoistoquímica mais agressivas, com impacto de pior sobrevida livre de doença. Fundamental identificar pacientes de alto risco para gerar políticas de educação e de rastreamento deste público-alvo.
Como vimos a incidência de CM entre AAJs vem aumentando nos EUA e no Brasil e estas mulheres têm desafios muito específicos, tanto na fase aguda de tratamento quanto na fase de seguimento. Elas precisam de um tratamento multidisciplinar bem coordenado. Elas merecem.
*Não aprovada no Brasil para esta indicação.
Autor:
Gilberto Amorim
Formado em 1992 na UFRJ • Residência Médica em Clínica Médica no HUCFF – UFRJ • Residência em Oncologia Clínica no INCA • Oncologista do INCA de 01/1998 até 04/2008 –Chefe do Serviço do HCIII de 11/1999 até 05/2001 e de 12/2003 até 12/2005 • Membro Titular da SBOC desde 1996 • Membro titular da “ASCO” desde 2001 e da “ESMO desde 2016 • Sócio Honorário da Sociedade Brasileira de Mastologia desde 2009 • Oncologista e Coordenador Nacional de Oncologia Mamária da “Oncologia D’Or”, desde 05/2011 • Membro voluntário do Comitê Científico da FEMAMA, do INSTITUTO ONCOGUIA e da Fundação Laço Rosa
Referências bibliográficas:
- Cathcart-Rake EJ; Ruddy KJ; Bleyer A and Johnson RH. Breast Cancer in Adolescent and Young Adult Women Under the Age of 40 Years. ascopubs.org/journal/ op on January 15, 2021: DOI https://doi. org/10.1200/OP.20. 00793
- Orlandini LF; Antonio MVN; Esperafico CR et al. Epidemiological Analyses Reveal a High Incidence of Breast Cancer in Young Women in Brazil. ascopubs.org/journal/ go on January 12, 2021: DOI https://doi. org/10.1200/GO.20. 00440
Câncer ginecológico: prevenir é melhor que remediar
Sem dúvida nenhuma quando temos a oportunidade de detectar uma doença grave ou uma neoplasia, como o câncer ginecológico, em suas fases iniciais, o tratamento torna-se mais em conta, a sobrevida melhora muito, enfim, todas as variáveis somam-se a favor do paciente. Não é diferente quando falamos em prevenção de neoplasias ginecológicas.

A prevenção primária para o câncer de mama está relacionada diretamente aos fatores modificáveis:
- Dieta: manutenção de peso adequado através de uma dieta balanceada. Evitar ganho de gordura corporal protege a conversão periférica hormonal que pode ser agressiva ao tecido mamário.
- Prática de atividade física regular: pelo menos 30 minutos de atividade por dia. Independente da perda de peso, protege pela diminuição contato com substâncias carcinogênicas com parede intestinal, melhora imunidade (defesas melhores contra agressões de células invasoras).
- Evitar ingestão de álcool: a redução ou o cessar melhora muito a chance protetiva contra neoplasias mamárias.
- Amamentação: importante fator modificável que também garante proteção ao tecido mamário em todas as idades. Quanto mais tempo (2 anos diminuem em 10% prevalência) for mantido o aleitamento materno, maior será a proteção da glândula contra o câncer de mama.
Outros
Fatores não modificáveis infelizmente não permitem intervenção da mulher para mudar o seu curso, como fatores hereditários e os relacionados ao ciclo reprodutivo (menarca precoce e menopausa tardia).
Por outro lado, quando falamos de câncer de colo uterino temos um agente potencialmente relacionado à sua gênese: o HPV (vírus do papiloma humano). Sabemos que a infecção pelo HPV é transitória, nos casos onde ela é persistente, temos a possibilidade de infecção por subespécies oncogênicas capazes de evoluir para câncer de colo uterino (principalmente), mas também podendo acometer vagina, vulva, ânus, pênis, orofaringe e boca.
A transmissão do vírus se dá por contato direto com a pele ou mucosa infectada.
A principal forma é pela via sexual, que inclui contato oral-genital, genital-genital ou mesmo manual-genital. Assim sendo, o contágio com o HPV pode ocorrer mesmo na ausência de penetração vaginal ou anal. Também pode haver transmissão durante o parto.
Não está comprovada a possibilidade de contaminação por meio de objetos, do uso de vaso sanitário e piscina ou pelo compartilhamento de toalhas e roupas íntimas.
Com a vacinação contra o HPV antes do início da vida sexual e fazendo o exame preventivo (de Papanicolaou ou citopatológico), que pode detectar as lesões precursoras. Quando essas alterações que antecedem o câncer são identificadas e tratadas é possível prevenir a doença em 100% dos casos.
O exame deve ser feito preferencialmente pelas mulheres entre 25 e 64 anos, que têm ou já tiveram atividade sexual. Os dois primeiros exames devem ser feitos com intervalo de um ano e, se os resultados forem normais, o exame passará a ser realizado a cada três anos.
Autor(a):
João Marcelo Martins Coluna
Médico Ginecologista e Obstetra formado pela Universidade Estadual de Londrina • Mestrado em Fisiopatologia pela Unoeste (Universidade Oeste Paulista) • Docente da Unoeste (Presidente Prudente) – departamento materno infantil • Preceptor Residência Médica Hospital Regional Presidente Prudente – SP • Plantonista Ginecologia e Obstetrícia Hospital Regional Presidente Prudente • Plantonista Ginecologia e Obstetrícia Hospital Estadual Dr. Odilo Antunes Siqueira (Presidente Prudente – SP) • Plantonista Ginecologia e Obstetrícia Santa Casa de Misericórdia de Adamantina
Plantonista Socorrista Santa Casa de Misericórdia Presidente Prudente • Médico Regulador ambulatorial município de Dracena – SP • Médico Preceptor ambulatorial UNIFADRA (Dracena – SP) • Ginecologista do serviço ambulatorial de Narandiba (SP) • Ginecologista e Obstetra do serviço ambulatorial de Pirapozinho (SP).
Referências bibliográficas:
- Ekinci O, Eren T, Kurtoglu Yakici M, Gapbarov A, Aydemir MA, Saglam ZA, Alimoglu O. Relationship Between Metabolic Syndrome and Postmenopausal Breast Cancer. Cir Esp. 2020 Nov;98(9):540-546.
- Saz-Parkinson Z, Monteagudo-Piqueras O, Granados Ortega J, Martínez Mondéjar E, Labrador Cañadas MV. “European Commission Initiative on Breast Cancer”: Recomendaciones seleccionadas de cribado de cáncer de mama de las guías europeas [“European Commission Initiative on Breast Cancer”: Selected Breast Cancer Screening Recommendations from the European Guidelines.]. Rev Esp Salud Publica. 2020 Dec 16;94:e202012179.
- Cohen PA, Jhingran A, Oaknin A, Denny L. Cervical cancer. Lancet. 2019 Jan 12;393(10167):169-182.
- Sundström K, Elfström KM. Advances in cervical cancer prevention: Efficacy, effectiveness, elimination? PLoS Med. 2020 Jan 28;17(1):e1003035.
- Das M. WHO launches strategy to accelerate elimination of cervical cancer. Lancet Oncol. 2021 Jan;22(1):20-21. doi: 1016/S1470-2045(20)30729-4. Epub 2020 Nov 26.
- Instituto Nacional de Câncer José Alencar Gomes da Silva. Dieta, nutrição, atividade física e câncer: uma perspectiva global: um resumo do terceiro relatório de especialistas com uma perspectiva brasileira / Instituto Nacional de Câncer José Alencar Gomes da Silva. – Rio de Janeiro: INCA, 2020. 140 p: il. color. Traduzido e adaptado de: Diet, nutrition, physical activity and cancer: a global perspective: a summary of the third expert report. Disponível em: https://www.inca.gov.br/sites/ufu.sti.inca.local/files/media/document/dieta_nutricao_atividade_fisica_e_cancer_resumo_do_terceiro_relatorio_de_especialistas_com_uma_perspectiva_brasileira.pdf
Anticuerpos maternos anti-SARS-CoV-2 cruzan la placenta y se detectan en neonatos

Dra. Naima Joseph
“Creo que el hallazgo más llamativo es que notamos alta respuesta neutralizante a la infección natural incluso en las infecciones asintomáticas, pero naturalmente se observó en mayor grado en personas con infección sintomática”, comentó a Medscape Noticias Médicas la Dra. Naima Joseph, maestra en salud pública de la Emory University School of Medicine, en Atlanta, Estados Unidos.
“Nuestros datos demuestran la capacidad materna para crear respuesta inmunitaria apropiada y robusta”, y la inmunidad protectora materna duró un mínimo de 28 días después de la infección, indicó la Dra. Joseph. “Además observamos títulos en sangre del cordón neonatal más elevados en madres con títulos más altos, lo cual indica una relación, pero necesitamos comprender mejor cómo ocurre la transferencia transplacentaria y establecer correlatos de protección neonatal para ver si la inmunidad materna puede también beneficiar a los recién nacidos, y de qué manera”.
Los investigadores analizaron de forma prospectiva la cantidad de inmunoglobulina G e inmunoglobulina M en muestras de sangre materna y de cordón obtenidas durante el parto de mujeres que resultaron positivas para COVID-19 en algún momento durante la gestación. Utilizaron enzimoinmunoanálisis de adsorción de anticuerpos para el dominio de unión a receptor de proteína en espiga del SARS-CoV-2.
Los 32 pares de madres-lactantes en el estudio fueron predominantemente de raza negra no hispanoamericanas (72%) e hispanoamericanas (25%) y 84% estaba afiliado a Medicaid como su pagador. Mayor proporción de las madres (72%) tenía por lo menos un trastorno concomitante, más frecuentemente obesidad, hipertensión o asma, o enfermedad pulmonar. Poco más de la mitad de las mujeres (53%) tuvo síntomas mientras cursaba con la infección, y 88% enfermó de COVID-19 durante el tercer trimestre. El tiempo promedio desde la infección hasta el parto fue de 28 días.
Todas las madres tenían anticuerpos de inmunoglobulina G, 94% tenía anticuerpos de inmunoglobulina G y 94%tenían anticuerpos neutralizantes contra el SARS-CoV-2. De las muestras de sangre de cordón, 91% tenía anticuerpos de inmunoglobulina G, 9% anticuerpos de inmunoglobulina M y 25% anticuerpos neutralizantes.
“Es tranquilizante que hasta ahora la respuesta fisiológica es exactamente la que esperábamos”, comentó a Medscape Noticias Médicas la Dra. Judette Louis, maestra en salud pública, profesora asociada de obstetricia y ginecología y presidenta del departamento de ginecología de la University of South Florida, en Tampa, Estados Unidos. “Es lo que esperaríamos, pero siempre es útil contar con más datos que respalden esto. Por lo demás, se está extrapolando lo que se sabe de otros trastornos”, destacó la Dra. Louis, quien moderó la sesión de resúmenes orales.
La infección sintomática se asoció con títulos de inmunoglobulina G más elevados de manera estadísticamente significativa que la infección asintomática (p = 0,03), pero no se observó correlación para inmunoglobulina M o anticuerpos neutralizantes. Además, aunque las madres que dieron a luz más de 28 días después de la infección tuvieron títulos de inmunoglobulina G más elevados (p = 0,05), no se observaron diferencias en la respuesta de inmunoglobulina M o neutralizante.
Los títulos en sangre de cordón de los lactantes fueron más bajos de manera estadísticamente significativa que sus muestras maternas correspondientes, sin importar los síntomas o la latencia desde la infección hasta el parto (p < 0,001), informó la Dra. Joseph.
“Se ha demostrado que la eficiencia de transferencia transplacentaria de otros patógenos se correlaciona con la inmunidad neonatal cuando el cociente sangre de cordón/materna es superior a 1”, indicó la Dra. Joseph en su presentación. Sus datos demostraron “eficiencia subóptima” con un índice de 0,81.
El tamaño pequeño de la muestra y la falta de un grupo de control fueron debilidades del estudio, pero una fortaleza importante fue disponer de una población con riesgo desproporcionadamente más alto para la infección y la morbilidad grave que la población general.
Implicaciones para la vacunación materna contra la COVID-19
Aunque todavía no se dispone de los datos, la Dra. Joseph señaló que han ampliado su protocolo para incluir mujeres embarazadas vacunadas.
“La clave para desarrollar una vacuna eficaz para mujeres embarazadas en realidad es caracterizar la inmunidad adaptativa durante la gestación. Creo que estos hallazgos aportan más información para el desarrollo de la vacuna al demostrar que la inmunidad materna es robusta”, añadió la especialista.
La Organización Mundial de la Salud recientemente recomendó no administrar vacunas contra COVID-19 a mujeres embarazadas, pero la Society for Maternal-Fetal Medicine y el American College of Obstetricians and Gynecologists después emitieron una declaración adjunta que reafirma que las vacunas contra COVID-19 autorizadas por la Food and Drug Administration (FDA) de Estados Unidos “no deben dejar de administrarse a personas embarazadas que optan por recibir la vacuna”.[2,3]
“Una pregunta que se plantean es si durante el embarazo se va a generar respuesta satisfactoria a la vacuna de la forma en que ocurriría en personas no embarazadas. Si podemos demostrar que así ocurre, esto puede proporcionar información que algunas madres necesitan para tomar sus decisiones”, señaló la Dra. Louis. Datos como los del estudio de la Dra. Joseph también aportan información para las recomendaciones sobre el momento oportuno de la vacunación materna.
“Por ejemplo, la Dra. Joseph demostró que 28 días después de la infección se tenían más anticuerpos, de manera que puede haber un escenario en que afirmemos que esta vacuna puede ser más beneficiosa a la mitad del embarazo para formar esos anticuerpos”, destacó la Dra. Louis.
Está surgiendo un consenso a partir de los datos de anticuerpos maternos
Los hallazgos del estudio de la Dra. Joseph reflejan los comunicados en un estudio publicado el 29 de enero en la versión electrónica de JAMA Pediatrics. En ese estudio, dirigido por el Dr. Dustin D. Flannery, D. O., del Children’s Hospital of Philadelphia, en Filadelfia, Estados Unidos, también se analizaron los niveles maternos y neonatales de anticuerpos de inmunoglobulina G e inmunoglobulina M contra el dominio que se une al receptor de la proteína en espiga del SARS-CoV-2.[4] Asimismo, se observó correlación positiva entre las concentraciones de inmunoglobulina G en sangre del cordón y materna (p < 0,001), pero notablemente, el coeficiente de títulos en sangre del cordón y materna fue mayor de 1, a diferencia de lo observado en el estudio de la Dra. Joseph.
Para su estudio, Flannery y sus colaboradores obtuvieron sueros de sangre materna y de cordón durante el parto de 1.471 pares de madres y lactantes, independientemente del antecedente de COVID-19 durante el embarazo. La edad materna promedio fue de 32 años, y poco más de una cuarta parte de la población (26%) la constituían mujeres de raza negra no hispanoamericanas. Alrededor de la mitad (51%) era de raza caucásica, 12% hispanoamericanas y 7% asiáticas.
Seis de cada 100 mujeres tenían anticuerpos de inmunoglobulina G o inmunoglobulina M en el parto, y 87% de los lactantes nacidos de estas madres tenía inmunoglobulina G medible en su sangre del cordón.
Ningún lactante tenía anticuerpos de inmunoglobulina M. Al igual que en el estudio presentado en el congreso de la Society for Maternal-Fetal Medicine, las infecciones de las madres incluyeron casos asintomáticos, leves, moderados y graves, y el grado de gravedad de los casos no tuvo efecto ostensible en las concentraciones de anticuerpo del lactante. La mayoría de las mujeres que resultaron positivas en las pruebas para COVID-19 (60%) no tenía síntomas.
De las 11 madres que tenían anticuerpos, pero cuyos lactantes no los tenían en la sangre del cordón, cinco solo tuvieron anticuerpos de inmunoglobulina M y seis tuvieron concentraciones significativamente más bajas de inmunoglobulina G que las observadas en las otras madres.
En un comentario sobre el estudio publicado en JAMA Pediatrics, la Dra. Flor Muñoz, del Baylor College of Medicine, en Houston, Estados Unidos, señaló que los hallazgos son motivo para tener optimismo sobre una estrategia de vacunación materna para proteger a los lactantes contra la COVID-19.
“Sin embargo, el periodo de vacunación materna para proteger al lactante, en contraposición a únicamente a la madre, exigiría un intervalo adecuado desde la vacunación hasta el parto (de por lo menos 4 semanas), mientras que la vacunación en una etapa temprana de la gestación e incluso en una etapa tardía del tercer trimestre podría todavía ser protectora para la madre”, afirmó la Dra. Muñoz.
Dado el intervalo de los esquemas de vacunación de dos dosis y el hecho de que la transferencia transplacentaria comienza más o menos en la semana 17 de la gestación, “la vacunación materna a partir de la primera etapa del segundo trimestre de la gestación podría ser óptima para lograr los máximos niveles de anticuerpos en el recién nacido”, escribió la Dra. Muñoz. Sin embargo, persisten interrogantes, por ejemplo, cuán eficaces son los anticuerpos neonatales para proteger contra la COVID-19 y cuánto tiempo duran después del nacimiento.
No se utilizó ninguna financiación externa en el estudio de la Dra. Joseph.
Las doctoras Joseph y Louis han declarado no tener ningún conflicto de interés económico pertinente. El estudio de JAMA Pediatrics fue financiado por el Children’s Hospital of Philadelphia. Un coautor recibió honorarios por consultoría de Sanofi Pasteur, Lumen, Novavax y Merck, no relacionados con el estudio. Muñoz prestó servicios en las juntas de vigilancia de datos y seguridad de Moderna, Pfizer, Virometix y Meissa Vaccines y recientemente ha recibido becas de Novavax Research y Gilead Research.
Medscape Noticias Médicas © 2021 WebMD, LLC
Citar este artículo: Anticuerpos maternos anti-SARS-CoV-2 cruzan la placenta y se detectan en neonatos – Medscape – 4 de feb de
Câncer de mama: diretrizes de mamografia em pacientes idosas
Atualmente não existem diretrizes em como fazer o seguimento mamográfico de mulheres idosas que tiveram câncer de mama quando a expectativa de vida é limitada. O objetivo dos experts foi, justamente, estabelecer essas recomendações para mulheres com mais de 75 anos.
Foi feita uma extensa revisão da literatura, debate entre os especialistas incluindo uma revisão crítica por parte da International Society for Geriatric Oncology. Estes guidelines foram publicados online no último dia 28 de Janeiro no JAMA Oncology.
A mamografia anual de rotina em mulheres com mais de 75 anos deveria ser interrompida, descontinuada em mulheres cuja expectativa de vida seria inferior a 5 anos, porém deveria prosseguir caso a expectativa fosse de 10 anos ou mais. Quando a expectativa está entre 5-10 anos a opinião dos pesquisadores é favorável a interromper.

Novas diretrizes avaliam faixa etária de idosas com câncer de mama
As diretrizes reforçam o conceito de que a decisão deve ser compartilhada com cada paciente avaliando risco vs benefício desta intervenção e as preferências individuais das pacientes. Os pesquisadores avaliaram que as condutas nesta faixa etária antes destas diretrizes são muito variadas, com cerca de 50% das mulheres com expectativa curta ainda fazem mamografias anuais.
Obviamente, pacientes que apresentem sinais e sintomas devem ser examinados e receber os exames diagnósticos pertinentes, e estas práticas devem continuar.
Muitos oncologistas acham que 75 anos é muito cedo e que 80 anos seria “mais confortável” para interromper este seguimento sistemático, mas na prática as estimativas de tempo de vida é que deveriam dirigir estas recomendações. Isso não é fácil, pois nem sempre estamos preparados para fazer estas estimativas com precisão em virtude das múltiplas comorbidades. Fundamental estreitar nossa parceria com os geriatras, os médicos de família destes pacientes, pois essa abordagem multidisciplinar pode ajudar a fazer esta estimativa. Muitos oncologistas preferem focar no risco individual, e sendo o risco de segundo primário baixo como de fato é na maioria das vezes esta discussão com a paciente fica um pouco mais simplificada. Outro questionamento que podemos fazer nestas situações seria a pergunta: “se tiver uma alteração na mamografia, a senhora está disposta a tomar as providências necessárias? Biópsia e eventual cirurgia?”
Pacientes portadoras de cânceres luminais (receptores hormonais positivos) têm baixo risco de recidiva e de segundo primário. Pacientes idosas com tumores triplo negativos ou HER2 positivos têm taxas de recidiva mais altas.
Há benefícios da mamografia anual em idosas com mais de 70 anos?
Na revisão feita pelos pesquisadores foi estimado que o risco em 10 anos variou de 1-15% para câncer de mama ipsilateral e 1-5% para a mama contralateral. Só para efeito de comparação, mulheres sem histórico pessoal de câncer de mama na mesma faixa etária seria de 2,2% em 5 anos. Um estudo prévio em mulheres entre 70-80 anos portadoras de câncer de mama indicou um risco anual de 1,1%. Um pouco mais alto que 0,7-0,9%/ano que é o esperado para a mesma faixa etária sem história familiar.
Os benefícios do rastreamento mamográfico nesta população não foram demonstrados. E não é fácil fazê-lo, pois documentar diminuição de mortalidade pode demorar vários anos de seguimento e tumores de crescimento lento não vão afetar a expectativa de vida nesta faixa etária.
Essas diretrizes podem ajudar os médicos e pacientes a tomarem decisões individualizadas sobre se e quando parar de fazer mamografia. Devemos levar em consideração aspectos do risco de recidiva do câncer, é verdade, mas também da saúde global da paciente e de suas preferências.
Recomendações da mamografia no Brasil
O Ministério da Saúde recomenda mamografia anual entre 50-69 anos entre mulheres sem diagnóstico prévio de câncer de mama, e não existem diretrizes diferentes para pacientes com histórico, mas o próprio IBGE tem reiteradamente indicado que a expectativa de vida entre mulheres em geral é maior que a dos homens e já chegou a 80,1 anos em 2019. Ainda segundo o IBGE uma mulher brasileira que tem 75 anos, tem ainda cerca de 12 anos de expectativa de vida e uma de 80 anos ainda tem 10,5 anos de expectativa de vida. Isto posto, o rastreamento de mulheres sem diagnóstico prévio e portadoras de câncer de mama também não deveria ser interrompido aos 69 anos, deveria seguir esta mesma lógica sugerida nesta nova diretriz.
Autor(a):
Gilberto Amorim
Formado em 1992 na UFRJ • Residência Médica em Clínica Médica no HUCFF – UFRJ • Residência em Oncologia Clínica no INCA • Oncologista do INCA de 01/1998 até 04/2008 –Chefe do Serviço do HCIII de 11/1999 até 05/2001 e de 12/2003 até 12/2005 • Membro Titular da SBOC desde 1996 • Membro titular da “ASCO” desde 2001 e da “ESMO desde 2016 • Sócio Honorário da Sociedade Brasileira de Mastologia desde 2009 • Oncologista e Coordenador Nacional de Oncologia Mamária da “Oncologia D’Or”, desde 05/2011 • Membro voluntário do Comitê Científico da FEMAMA, do INSTITUTO ONCOGUIA e da Fundação Laço Rosa
Referências bibliográficas:
- Freedman R; Minami C; Winer E; Morrow M et al. Individualizing Surveillance Mammography for Older Patients After Treatment for Early-Stage Breast Cancer Multidisciplinary Expert Panel and International Society
of Geriatric Oncology Consensus Statement JAMA Oncol. doi:10.1001/jamaoncol.2020.7582 Published online January 28, 2021. - https: //www.ibge.gov.br/busca.html
Gestational Diabetes Carries CVD Risk Years Later

Erica P. Gunderson, PhD
Women who’ve had gestational diabetes are 40% more likely to develop coronary artery calcification later in life than those who have never had it, and attaining normal glycemic levels doesn’t diminish their midlife risk for atherosclerotic cardiovascular disease.
“The new finding from this study is that women with gestational diabetes had twice the risk of coronary artery calcium, compared to women who never had gestational diabetes, even though both groups attained normal blood sugar levels many years after pregnancy,” lead author Erica P. Gunderson, PhD, MS, MPH, said in an interview about a community-based prospective cohort study of young adults followed for up to 25 years, which was published in Circulation (2021 Feb 1. doi: 10.1161/CIRCULATIONAHA.120.047320).
Previous studies have reported a higher risk of heart disease in women who had gestational diabetes (GD) and later developed type 2 diabetes, but they didn’t elucidate whether that risk carried over in GD patients whose glycemic levels were normal after pregnancy. In 2018, the American College of Cardiology/American Heart Association Cholesterol Clinical Practice Guidelines specified that a history of GD increases women’s risk for coronary artery calcification (CAC).
This study analyzed data of 1,133 women ages 18-30 enrolled in the Coronary Artery Risk Development in Young Adults (CARDIA) study who had no diabetes in the baseline years of 1985-1986 and had given birth at least once in the ensuing 25 years. They had glucose tolerance testing at baseline and up to five times through the study period, along with evaluation for GD status and coronary artery calcification CAC measurements at least once at years 15, 20 and 25 (2001-2011).
CARDIA enrolled 5,155 young Black and White men and women ages 18-30 from four distinct geographic areas: Birmingham, Ala.; Chicago; Minneapolis; and Oakland, Calif. About 52% of the study population was Black.
Of the women who’d given birth, 139 (12%) had GD. Their average age at follow-up was 47.6 years, and 25% of the GD patients (34) had CAC, compared with 15% (149/994) in the non-GD group.
Gunderson noted that the same relative risk for CAC applied to women who had GD and went on to develop prediabetes or were diagnosed with type 2 diabetes during follow-up.https://659177c6dbc0aa51a616452f311f1d01.safeframe.googlesyndication.com/safeframe/1-0-37/html/container.html
Risks Persist Even in Normoglycemia
In the GD group, the adjusted hazard ratio for having CAC with normoglycemia was 2.3 (95% confidence interval, 1.34-4.09). The researchers also calculated HRs for prediabetes and incident diabetes: 1.5 (95% CI, 1.06-2.24) in no-GD and 2.1 (95% CI, 1.09-4.17) for GD for prediabetes; and 2.2 (95% CI, 1.3-3.62) and 2.02 (95% CI, 0.98-4.19), respectively, for incident diabetes (P = .003).
“This means the risk of heart disease may be increased substantially in women with a history of gestational diabetes and may not diminish even if their blood-sugar levels remain normal for years later,” said Gunderson, an epidemiologist and senior research scientist at the Kaiser Permanente Northern California Division of Research in Oakland.
“The clinical implications of our findings are that women with previous GD may benefit from enhanced traditional CVD [cardiovascular disease] risk factor testing – i.e., for hypertension, dyslipidemia, and hyperinsulinemia,” Gunderson said. “Our findings also suggest that it could be beneficial to incorporate history of GD into risk calculators to improve CVD risk stratification and prevention.”
Strong Findings Argue for More Frequent CVD Screening
These study results may be the strongest data to date on the long-term effects of GD, said Prakash Deedwania, MD, professor of cardiology at the University of California, San Francisco. “It’s the strongest in the sense in that it’s sponsored, involved four different communities in different parts of the United States, enrolled individuals when they were young and followed them, and saw very few patients drop out for such a long-term study.” The study reported follow-up data on 72% of patients at 25 years, a rate Deedwania noted was “excellent.”
“Patients who have had GD should be screened aggressively – for not only diabetes, but other cardiovascular risk factors – early on to minimize the subsequent risk of cardiovascular disease is a very important point of this study,” he added. In the absence of a clinical guideline, Deedwania suggested women with GD might have screening for CV risk factors every 5-7 years depending on their risk profile, but emphasized that parameter isn’t settled.
Future research should focus on the link between GD and CVD risk, Gunderson said. “Research is needed to better characterize the severity of GD in relation to CVD outcomes, and to identify critical pregnancy-related periods to modify cardiometabolic risk.” The latter would include life-course studies across the full pregnancy continuum from preconception to lactation. “Interventions for primary prevention of CVD and the importance of modifiable lifestyle behaviors with the highest relevance to reduce both diabetes and CVD risks during the first year postpartum merit increased research investigation,” she added.https://659177c6dbc0aa51a616452f311f1d01.safeframe.googlesyndication.com/safeframe/1-0-37/html/container.html
Future studies might also explore the role of inflammation in the GD-CVD relationship, Deedwania said. “My hypothesis is, and it’s purely a hypothesis, that perhaps the presence of coronary artery calcification scores score in these individuals who were described as having normal glucose but who could be at risk could very well be related to the beginning of inflammation.”
Gunderson and Deedwania have no financial relationships to disclose. The study was funded by the National Institute of Diabetes and Digestive and Kidney Diseases and the National Heart, Lung, and Blood Institute.
This article originally appeared on MDedge.com, part of the Medscape Professional Network.
Medscape Medical News © 2021 WebMD, LLC
Cite this: Gestational Diabetes Carries CVD Risk Years Later – Medscape – Feb 01, 2021.