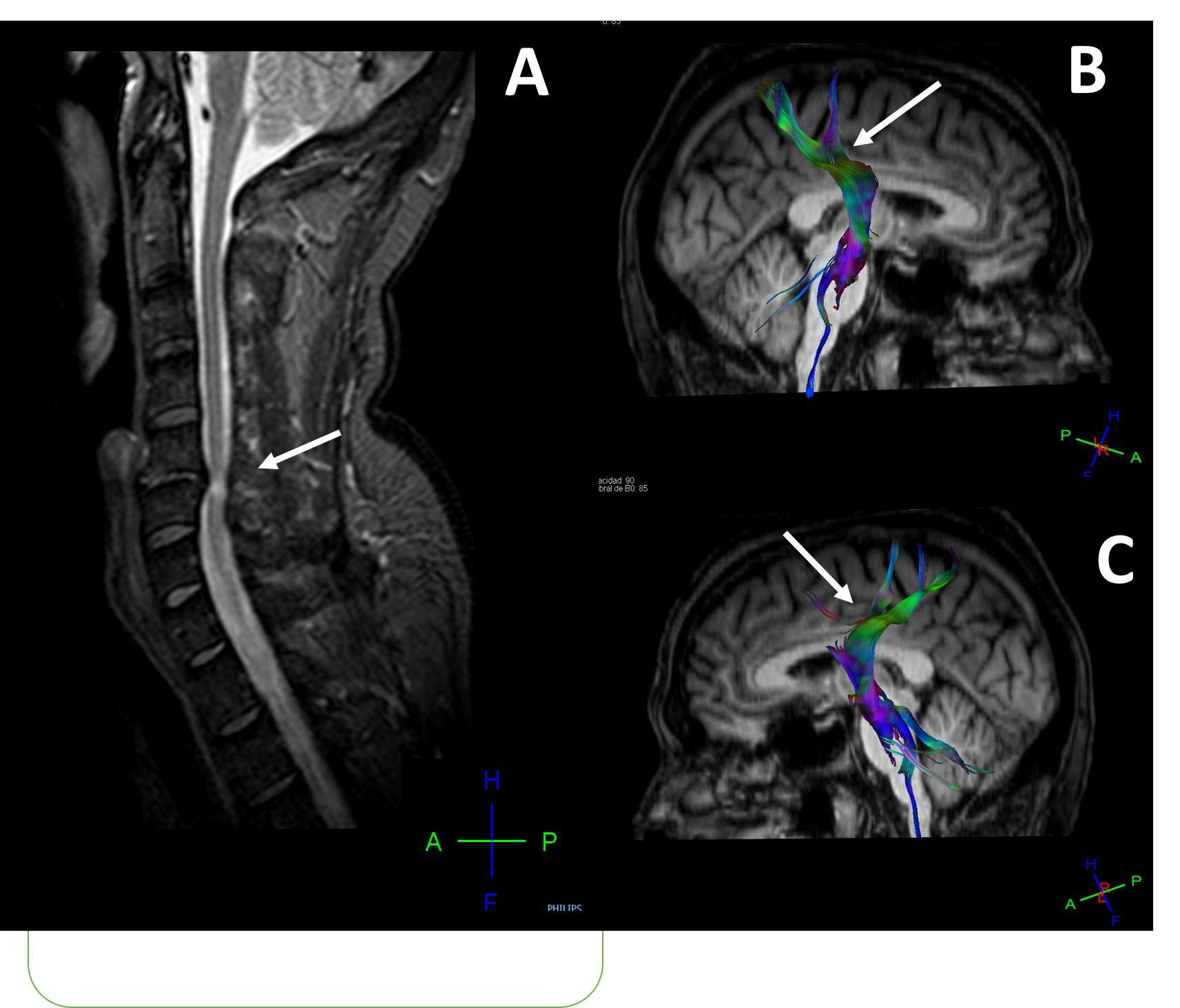
France — Victime d’une chute lors de la 13e étape du Tour de France, Romain Bardet remonte sur son vélo et franchit la ligne d’arrivée. Le soir même, dans un communiqué, le Dr Eric Bouvat, médecin de l’équipe professionnelle AG2R La Mondiale et du centre de formation dont fait partie le coureur cycliste, fait savoir : « Romain souffre d’une commotion cérébrale dont l’intensité et les signes qu’il présentait après l’étape ont nécessité que notre équipe médicale lui fasse passer un scanner cérébral au CHU de Clermont-Ferrand, […]. Cet examen n’a pas révélé de lésion. Il est cependant nécessaire que Romain Bardet stoppe ses activités sportives et il ne pourra donc pas reprendre le départ de l’étape demain ». Pour des raisons médicales, la Grande Boucle prend fin pour Romain Bardet, pour qui la reprise ne se fera pas avant plusieurs semaines. Dans le même temps, des questions émergent sur la sécurité des coureurs en course.
Faut-il un protocole “commotion cérébrale” dans le cyclisme comme dans les sports de contact, comme l’a évoqué lui-même Romain Bardet dans une interview au Parisien . Faut-il davantage faire appel à la vidéo ? Nous avons demandé au Dr Bouvat – que nous avions déjà interviewé fin août – des précisions sur la prise en charge médicale d’un sportif lors d’une chute sur une course cycliste et sur les pistes possibles pour l’optimiser.
Medscape édition française : Qui est en charge des décisions médicales lorsque se produit un accident dans une course cycliste comme le Tour de France ?
Dr Eric Bouvat : Pendant la course, c’est le médecin de l’organisation de la course [Pour le Tour, le Dr Florence Pommerie, ndlr] qui est responsable et qui prend en charge les patients sportifs en cas d’accidents ou de problème médical. En revanche, avant et après la course, c’est le médecin d’équipe. Pendant la course, nous, médecins d’équipes n’avons pas à agir. A la limite, nous « n’avons pas le droit d’agir » puisqu’il y a un médecin de course, accompagné d’un système médical roulant gradué, dont le staff intervient en fonction de la gravité estimée de l’incident. Donc, pendant toute la durée de la course, les coureurs sont les patients du médecin de course.
Medscape édition française : Comment fait-on pour gérer l’ensemble des coureurs ?
Dr Eric Bouvat : Avec 176 coureurs dans 22 équipes au départ du Tour 2020, il est évident qu’il n’y a pas un médecin de course derrière chacun d’entre eux, mais plusieurs, répartis dans des voitures et des ambulances tout du long du parcours. Malgré tout, il reste néanmoins très peu fréquent que le médecin assiste à la chute d’un coureur. Et il n’existe pas à ce jour de système de montage vidéo qui permette de voir dans la minute ce qui s’est passé.
Quand le médecin est proche de l’incident, il se rend sur place pour comprendre comment le traumatisme s’est produit et examiner le cycliste qui a chuté. Mais quand il s’est produit plusieurs chutes espacées sur une courte période, alors le médecin remonte dans la voiture, et va voir les coureurs un par un – lesquels, entre-temps, sont remontés sur leur vélo et repartis – avant de prendre la décision qui s’impose (quand c’est nécessaire). Ce sont généralement des médecins formés et habitués à prendre en charge des traumatismes de la voie publique. En revanche, dès que le coureur termine l’étape, le médecin d’équipe reprend la main, après que le médecin de course lui a fait les transmissions médicales adéquates et des préconisations de prise en charge. C’est ensuite au médecin d’équipe, au vu des informations qu’il a reçues (ralentis des images télévisées, propos recueillis, mais surtout de la clinique de son patient), qui décide de la marche à suivre d’un point de vue médical.
Medscape édition française : Quelle a été votre décision dans le cas de Romain Bardet ?
Dr Eric Bouvat : Au vu de ses symptômes, nous avons fait réaliser un scanner immédiatement après l’arrivée de la course et décidé de l’arrêt du Tour. Nous avons toutefois demandé une IRM le lendemain pour vérifier les images du scanner qui étaient difficiles à interpréter. Nous allons désormais établir un programme pour sa récupération.
Medscape édition française : La question des commotions cérébrale s’est déjà posé dans le cyclisme ?
Dr Eric Bouvat : La question du traumatisme crânien – voire même du décès par traumatisme grave – se pose à chaque fois de façon différente. D’ailleurs, ce n’est pas le traumatisme crânien qui est problématique en soi mais le traumatisme encéphalique, quand l’encéphale se cogne à la boîte crânienne et par décélération va créer des lésions à l’intérieur du cerveau. Le tout est de proposer et de mettre en place un système encore plus efficace en termes de prise en charge.
Medscape édition française : Quels progrès a-t-on fait dans le domaine de la protection des blessures à la tête chez les cyclistes ?
Dr Eric Bouvat : Les choses avancent, mais lentement. Quand j’étais coureur cycliste à l’adolescence, on s’entrainait sans casque et on participait aux courses coiffé d’un casque à boudin. Dans les catégories senior, la seule protection que l’on portait était…une casquette ! Depuis, les mesures de protection ont évolué. Désormais, le casque est obligatoire en course et on le porte aussi à l’entrainement. Ce n’est pas le cas chez nous, mais certains pays ont adopté une législation où le port du casque est obligatoire dès que l’on prend son vélo – c’est le cas en Australie, en Nouvelle-Zélande, et en Espagne hors agglomération–, et son absence sanctionnée par une amende [En France, le port du casque est obligatoire pour les – de 12 ans, conducteur ou passager, depuis mars 2017, ndlr]. Il existe par ailleurs des « protocoles » écrits de prise en charge des traumatismes crâniens, applicables notamment dans le football américain et dans la boxe. Le cyclisme n’est pas a priori le sport le plus concerné, mais s’il faut faire évoluer les choses – au-delà des protocoles médicaux qui existent déjà – pour aller vers plus de précautions vis-à-vis des blessures graves des sportifs, on le fera.
Medscape édition française : Quels pistes pourrait-on évoquer pour optimiser le repérage et la prise en charge des coureurs en course ?
Dr Eric Bouvat : On peut discuter, la question de la formation des personnels non-médicaux, qui sont susceptibles d’être les premiers présents sur le site de la chute lors des courses. On forme bien les gens à faire un massage cardiaque, pourquoi ne pas les former aux premiers gestes en cas de trauma crânien.
On doit aussi s’interroger sur le rôle des images et de la vidéo, qui aujourd’hui n’est pas présente partout sur la course. En effet, dans ces accidents (équivalent à ceux de la voie publique), qui ont souvent lieu à grande vitesse, le premier élément dont le médecin a besoin, est de savoir quel a été exactement le mécanisme du traumatisme car de celui-ci va dépendre les lésions que l’on va avoir à soupçonner et qui vont donc conditionner les décisions la prise en charge initiale. Faudrait-il utiliser des caméras portatives de type « GoPro » ou bien des drones pour survoler la course – même si dans les étapes de montagne, on peut avoir plusieurs pelotons différents, ce qui ne simplifie pas la tâche ? Il pourrait exister un médecin superviseur de course ayant l’accès immédiat à la vidéo. Faut-il imaginer des capteurs placés dans les casques qui pourraient donner des indications sur l’importance de l’impact sur le crâne ? Il faut systématiser le passage d’information entre médecin de course et médecin d’équipe après les arrivées lorsqu’un coureur a été blessé. Beaucoup d’options mériteraient d’être discutées.
Medscape édition française : Peut-on envisager de médiquer le coureur blessé pendant la course ?
Dr Eric Bouvat : Non, il faut empêcher ou au moins réglementer la délivrance de médicaments pendant la course, alors que le coureur est en plein effort et que donc son tube digestif est en souffrance. Les risques de effets indésirables médicamenteux sont ainsi très augmentés. De plus, délivrer à l’aveugle, sans examen préalable, un médicament à un sportif en plein effort va à l’encontre de toute bonne pratique médicale.
De façon générale, l’optimisation de la prise en charge relève à la fois de questions d’organisation, de formation et de l’évaluation de tous les paramètres qui entrent en compte, de façon à pouvoir agir sur les plus efficaces.
Medscape édition française : Et quand c’est le coureur, lui-même, qui veut remonter sur le vélo ?
Dr Eric Bouvat : De même qu’un médecin dans son cabinet va convaincre son patient qu’il doit prendre du repos, le médecin de course doit expliquer au cycliste que les arguments médicaux dont il dispose lui interdisent, pour sa santé, de remonter sur son vélo. Mais, c’est loin d’être facile, car prendre la bonne décision au bon moment dans un contexte de course suppose de disposer de médecins ayant beaucoup d’expérience et de compétences.
Les médecins supervisant les combats de boxe, s’ils prennent la décision de jeter l’éponge pour protéger la santé de leur boxeur, sont suivi obligatoirement dans leurs décisions d’où l’arrêt définitif du combat. Cela devrait être la même chose dans tous les sports à risque de lésions graves. Il faudra cependant sans doute former des médecins à cet exercice qui nécessite pour eux de prendre leurs responsabilités en toute connaissance de cause.
Actualités Medscape © 2020
Citer cet article: Faut-il un “protocole commotion” dans le cyclisme? L’éclairage du Dr Eric Bouvat, médecin de l’équipe AG2R La Mondiale – Medscape – 17 sept 2020.