Use of the sodium-glucose cotransporter 2 (SGLT2) inhibitor diabetes drug class “may lower the risk of serious renal events in routine clinical practice,” new data from a Scandinavian registry indicate.
The patients, for the most part, had no kidney disease at baseline.
These real-world participants with type 2 diabetes who were newly prescribed an SGLT2 inhibitor rather than a dipeptidyl peptidase-4 (DPP-4) inhibitor were 58% less likely to have a serious renal event within the next 1.7 years.
“Complementing data from clinical trials, this study provides further support for the use of SGLT2 inhibitors in a broad range of patients with type 2 diabetes,” Björn Pasternak, MD, PhD, Karolinska Institute, Stockholm, Sweden, and colleagues summarize in their article published online April 29 in BMJ.
“Overall, the findings by Pasternak and colleagues add to the impressive track record for SGLT2 inhibitors,” writes Steven M. Smith, PhD, Department of Pharmacotherapy and Translational Research and Center for Integrative Cardiovascular and Metabolic Disease, University of Florida, in an accompanying editorial.
And he stressed, “Although SGLT2 inhibitors appeared particularly beneficial in people with cardiovascular disease or chronic kidney disease, it is perhaps more informative that these drugs were associated with a lower risk of development and progression of diabetic kidney disease in patients without these overt comorbidities, who have largely been excluded from clinical trials.”
Most Patients Had No CKD, Low Rate of CVD in Real-World Study
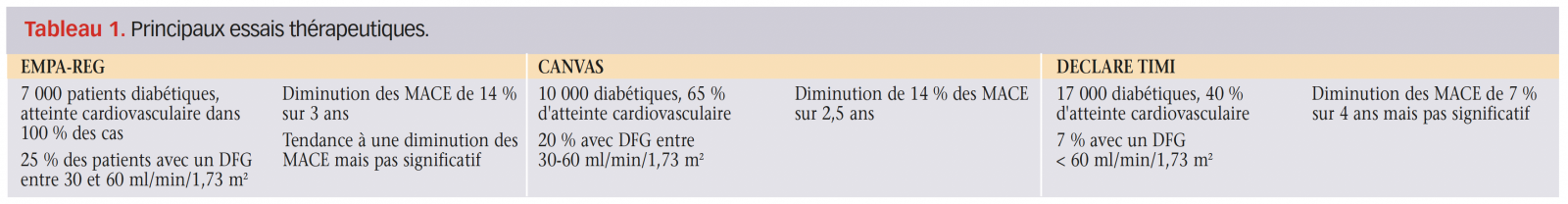
Type 2 diabetes is a leading cause of kidney failure, but in several trials, SGLT2 inhibitors — which reduce blood pressure, weight, and albuminuria — had a beneficial effect on renal outcomes, the authors write.
And in the first dedicated renal trial of one of these agents, CREDENCE, patients with type 2 diabetes and chronic kidney disease had better outcomes with canagliflozin than with placebo; the agent was subsequently approved by the US Food and Drug Administration in September 2019 for additional indications of reducing the risk of end-stage kidney disease and worsening of kidney function, among other new indications. Other SGLT2 inhibitors are being studied in renal outcomes trials, including dapagliflozin in patients with CKD in DAPA-CKD, which was stopped early at the end of March because of overwhelming efficacy of the drug.
But these key trials “left important questions unanswered for clinicians and patients,” notes Smith.
“All were placebo controlled and had highly selected participants, making the results hard to translate to real-world use.”
To investigate this, Pasternak and colleagues identified 38,273 new users of SGLT2 inhibitors and 107,854 new users of DPP-4 inhibitors in national registry data from 2013 to 2018 in Sweden, Denmark, and Norway.
They matched 29,887 new users of SGLT2 inhibitors with 29,887 new users of DPP-4 inhibitors.
In the SGLT2-inhibitor group, roughly two thirds of patients received dapagliflozin (66.1%), a third received empagliflozin (32.6%), and few received canagliflozin (1.3%), for a mean of 1.4 years.
In the DPP-4 group, close to two thirds of patients received sitagliptin (64.8%), followed by vildagliptin (20.0%), linagliptin (10.2%), saxagliptin (2.8%), and alogliptin (2.2%), for a mean of 2.0 years.
The matched cohort included 31% of patients from Sweden, 48% from Denmark, and 21% from Norway.
The patients were a mean age of 61 years and 39% were female.
About one in five (19%) had a history of major cardiovascular disease and only 3.3% had a history of chronic kidney disease.
Most patients (82%) were receiving metformin, 26% were taking insulin, and 8% were not receiving any antidiabetic medication.
The primary outcome, serious renal events, was a composite of renal replacement therapy (dialysis or kidney transplant), death from renal causes, and hospital admission for renal events, and this occurred in 2.6 per 1000 person-years in the SGLT2 inhibitor group versus 6.2 such events per 1000 person-years in the DPP-4 inhibitor group, for a hazard ratio of 0.42 (95% CI, 0.34 – 0.53).
When splitting these into their components — the secondary outcomes — patients in the SGLT2 inhibitor group were less likely to need dialysis or a kidney transplant (HR, 0.32) or admission to hospital for kidney disease (HR, 0.41) — but ultimately they did not have a significantly lower likelihood of dying from renal causes (HR, 0.77).
The outcomes were similar in men and women and in younger and older patients (age 35-64 and 65-84) living in any of the three countries or starting empagliflozin or dapagliflozin.
When the data were adjusted for A1c and estimated glomerular filtration rate (in Swedish and Danish patients) as well as blood pressure, body mass index, and smoking (in Swedish patients), the hazard ratios for the primary outcome increased from 0.41 to 0.50 in Swedish patients and from 0.42 to 0.55 in Danish patients indicating there was some confounding by these variables.
And because this was an observational study, other “unmeasured confounding cannot be ruled out,” the researchers say; Smith agreed.
More Real-World Trials Needed, Ertugliflozin Is Not Renoprotective
Smith calls for studies to see if the findings would be similar in low-income countries that have a high rate of kidney disease.
“Additional pragmatic comparative effectiveness trials in real-world settings and more diverse populations could add further support for broader access to these drugs, not only in high income countries but also in lower income countries where the burden of kidney disease is disproportionately high,” he concludes.
However, SGLT2 inhibitors are costly drugs.
And as recently reported, perhaps this track record for improved renal outcomes does not extend to all drugs in this class.
Recently report topline results from the Evaluation of Ertugliflozin Efficacy and Safety Cardiovascular Outcomes (VERTIS CV) trial show ertugliflozin was not superior to placebo for the composite outcome of renal death, dialysis/transplant, or doubling of serum creatinine.
The study was supported by the Swedish Cancer Society, Nordic Cancer Union, and Novo Nordisk Foundation. Pasternack was supported by a grant from the Strategic Research Area Epidemiology program at Karolinska Institute. Disclosures for the other authors are listed in the article. Smith has reported receiving research funding from the National Institutes of Health and serves on the board of directors for the Consortium for Southeastern Healthcare Quality.
BMJ. Published online April 29, 2020. Full text,
Medscape Medical News © 2020 WebMD, LLC
Cite this: SGLT2 Inhibitors May Prevent Diabetic Kidney Disease – Medscape – May 04, 2020.