dermatologia
Lengua, palma de la mano y planta del pie, las nuevas “víctimas” de la COVID-19

A un año del primer caso de COVID-19 en España, esta enfermedad mantiene intacta su capacidad de sorprender al colectivo médico. Cada día está más claro que los efectos de la infección provocada por el SARS-CoV-2 van mucho más allá de la pérdida de olfato y los daños pulmonares, como se muestra en un estudio liderado por el Hospital Universitario de la Paz, publicado recientemente en British Journal of Dermatology.[1]
En este estudio con 666 pacientes con COVID-19 ingresados en el hospital de campaña de Ifema entre el 10 y el 25 de abril de 2020 con neumonías leves o moderadas, y cuya primera autora es la Dra. Almudena Nuño-González, dermatóloga del Hospital Universitario de La Paz, se observó que una parte significativa de ellos sufrió lesiones mucocutáneas, orales y palmoplantares.
Este estudio, pionero a nivel mundial, realizado por profesionales del Hospital Universitario de La Paz y de Atención Primaria del Servicio Madrileño de Salud (SERMAS) de la Comunidad de Madrid, sirvió para corroborar las declaraciones previas del Dr. Tim Spector, profesor de epidemiología genética en el King’s College London, en Londres, Inglaterra, que a mediados de enero advirtió que “una de cada cinco personas con COVID-19 presenta síntomas poco comunes que no se incluyen en la lista oficial del Public Health England, como erupciones cutáneas.
Además se está registrando un número creciente de ‘lengua COVID’ y extrañas úlceras bucales”.
Sin embargo, el objetivo de este estudio no era demostrar la veracidad de las afirmaciones del Dr. Spector, ya que estas se realizaron meses después de su finalización.
“Lo que en realidad buscábamos era comprobar cuáles eran las lesiones dermatológicas más frecuentes en pacientes con COVID-19. Dado que en Ifema a todos los pacientes les habían diagnosticado COVID-19, fue un lugar en el que nos resultó fácil conseguir fotografías de las lesiones cutáneas”, explicó la Dra. Pilar Martín-Carrillo, del Consultorio Colmenarejo del SERMAS, participante también en la investigación.
Alteraciones orales en pacientes con COVID-19
El promedio de edad de los 666 pacientes con COVID-19 en los que se realizó el estudio era de 55,67 años, con ligera predominancia femenina (58%) y casi la mitad (47,1%) era de origen latinoamericano; 304 de estos pacientes (45,65%) presentaron una o más manifestaciones mucocutáneas, 78 de ellos (25,65%) padecieron alteraciones en la mucosa oral, incluyendo papilitis lingual transitoria (11,5%), glositis con marcas de los dientes en los laterales (6,6%), úlceras bucales (6,9%), glositis con depapilación en parches (3,9%) y sensación de ardor (5,3%). Todas estas manifestaciones aparecieron generalmente asociadas con disgeusia.
La Dra. Nuño señaló que algunos de estos síntomas podrían estar provocados por factores ajenos al SARS-CoV-2, “como algunos fármacos o la ventilación con oxígeno, que seca la boca y puede irritar la lengua.
Sin embargo, la lengua depapilada es 100% debida a la COVID-19, porque esto no se da por ninguna circunstancia ni ningún tratamiento”, afirmó a Univadis España.
“Este es un hallazgo que puede ayudar al diagnóstico, como la pérdida de olfato o del gusto. Son síntomas muy característicos”, añadió.
Lesiones palmoplantares en pacientes con COVID-19
Por otro lado, también se detectaron alteraciones en la piel de las palmas de las manos y las plantas de los pies en 121 pacientes (39,8%), mayoritariamente descamaciones 25,3% (77 pacientes), manchitas de color rojizo o marrón en 46 de ellos (15,1%) y sensación de ardor conocida como eritrodisestesia en 7% de los pacientes al comienzo de la infección.
Otras manifestaciones observadas fueron urticaria (6,9%), sarpullidos (2,9%) y erupciones vesiculares (1,6%). Tanto la urticaria como los sarpullidos se observaron en cualquier estadio de la enfermedad, mientras que las erupciones vesiculares típicamente aparecieron en los primeros días después de haber comenzado a manifestarse los síntomas. Ambas, la urticaria y las erupciones vesiculares, fueron observadas en los pacientes más jóvenes.
Una variedad de manifestaciones clínicas
La infección por SARS-CoV-2 se ha relacionado con múltiples síntomas: respiratorios, trombóticos, neurológicos, digestivos o cutáneos. Estos últimos se han clasificado en cinco tipos: lesiones acroisquémicas, lesiones vesiculares, erupción urticarial, exantema maculopapular o lesiones livedoides. Sin embargo, hasta la publicación de este trabajo no se habían considerado las alteraciones orales ni las lesiones palmoplantares asociadas a la COVID-19.
Los autores concluyeron que la cavidad oral “se puede alterar por la enfermedad COVID-19. El edema lingual con papilitis lingual transitoria en forma de U o la glositis con depapilación en parches son signos muy característicos, al igual que la sensación de ardor en la cavidad oral. Este ardor puede aparecer también en palmas y plantas con color rojizo o descamación y manchas. Todos pueden ser signos clave para un diagnóstico precoz de esta enfermedad”.
Todos los autores han declarado no tener ningún conflicto de interés económico pertinente.
Medscape Noticias Médicas © 2021 WebMD, LLC
Citar este artículo: Lengua, palma de la mano y planta del pie, las nuevas “víctimas” de la COVID-19 – Medscape – 11 de feb de 2021.
Nouvelles recommandations ESMO : l’alopécie sous traitements

Europe–L’European Society of Medical Oncology (ESMO) a publié fin 2020 des recommandations de prise en charge de l’alopécie induite par la chimiothérapie et l’hormonothérapie[1].
Il s’agit d’un effet indésirable fréquemment rencontré dans ce contexte et sous-estimé dans bon nombre d’études. Selon un registre néerlandais, près de la moitié des patients traités par chimiothérapie perdraient plus de la moitié de leurs cheveux (alopécie de grade 2). L’alopécie induite par une hormonothérapie est moins bien documentée, mais pas moins invalidante pour les patients, elle pourrait concerner environ 25% des sujets sous tamoxifène. L’alopécie peut être partielle, diffuse ou inégalement répartie. Elle peut toucher les sourcils, cils et les poils du corps.
L’alopécie chimio-induite débute généralement 1 à 3 semaines après le début du traitement. Son intensité dépendra du type, de la dose, du mode d’administration et du temps entre les perfusions. Les cheveux recommencent généralement à repousser 2 à 3 mois après la fin du traitement. Un changement de texture et de couleur peut survenir à la repousse. Les alopécies, même de grade 1 peuvent être psychologiquement difficiles à vivre pour les patients.
L’alopécie induite par l’hormonothérapie est plus souvent de grade 1 et plus fréquente chez les femmes ménopausées. Elle se développe plus souvent entre 6 et 18 mois après le début du traitement.
Les solutions préventives et curatives sont encore peu nombreuses et peu efficaces. De fait, il est important de prévenir les patients de ces effets indésirables avant de commencer le traitement et d’évoquer la possibilité d’avoir recours momentanément à une prothèse capillaire, un turban ou un chapeaux
Qu’est-il préconisé en prévention ?
- La seule méthode préventive est le port du casque réfrigéré. Cette méthode a cependant quelques contre-indications, notamment les hémopathies malignes, la radiothérapie totale du cerveau, la dystrophie post-traumatique due au froid, etc. Cette méthode a une efficacité toute relative. Elle est globalement plus importante sous taxanes et moindre sous traitement associant des anthracyclines combinées avec des taxanes ou le cyclophosphamide.
Lorsque l’atteinte est présente, comment la prendre en charge ?
- Il est utile de vérifier les taux sériques de TSH, vitamine D, zinc, ferritine pour corriger une éventuelle carence.
- L’administration de biotine (2,5 mg ou 2.500 microgrammes par jour) ou d’acide orthosilicique (silicone 10 mg par jour) peut être considérée, mais n’est généralement pas recommandée.
- Lorsque la chimiothérapie est terminée, le minoxidil 5% en topique peut favoriser la repousse.
- L’administration de spironolactone 50-100 mg deux fois par jour peut améliorer les alopécies de grade 2 dans certains cas. Mais le ratio bénéfice/risque ne justifie pas une utilisation en routine, et la spironolactone de fait pas l’objet de recommandations. Le bimatoprost en solution ophtalmologique peut également être utilisé en cas de chute des cils, mais n’est généralement pas recommandé.
Cet article a été initialement publié sur Univadis.fr, membre du réseau Medscape.
Actualités Medscape © 2021
Citer cet article: Nouvelles recommandations ESMO : l’alopécie sous traitements – Medscape – 25 janv 2021.
Dezembro laranja: câncer de pele

Durante o mês de dezembro, a Sociedade Brasileira de Dermatologia realiza a campanha nacional de prevenção ao câncer de pele, que é responsável por cerca de um terço de todos os casos de câncer diagnosticados no Brasil. Devido sua alta prevalência na população e às características tropicais de nosso país, é fundamental que médicos não dermatologistas reconheçam os principais sinais de suspeita para o câncer de pele.
O câncer de pele é classificado em dois tipos: câncer de pele não melanoma (CPNM), que compreende o carcinoma basocelular (CBC) e o carcinoma espinocelular (CEC), e o câncer de pele melanoma. O carcinoma basocelular é o tipo mais comum entre os três e também o menos agressivo, enquanto o melanoma é o tipo mais raro e também mais grave.
Carcinoma basocelular
O carcinoma basocelular (CBC) é responsável por cerca de 80% dos cânceres de pele não melanoma e tem como principal fator de risco a exposição à radiação ultravioleta, inclusive exposições solares intensas de modo intermitente. Pacientes com genodermatoses, como síndrome de Gorlin Goltz, xeroderma pigmentoso e epidermólise bolhosa também possuem mais risco de desenvolver CBC. As células neoplásicas se originam na camada basal da epiderme.
Clinicamente, o CBC pode se apresentar de várias formas. A mais comum é a forma nodular, onde há uma pápula ou nódulo eritematoso, com brilho perláceo e presença de telangiectasias arboriformes e ulceração. Mas, existem lesões eritematoescamosas e até lesões mal delimitadas, com aspecto cicatricial.
A evolução do carcinoma basocelular é muito lenta e, se não tratado, pode ser localmente agressivo, invadindo estruturas adjacentes. É mais frequente na face, em áreas fotoexpostas, mas pode ocorrer em outras áreas do corpo.
Carcinoma espinocelular
O carcinoma espinocelular (CEC) é o segundo tipo mais frequente de CPNM, correspondendo a aproximadamente 20% dos casos. O principal fator de risco é novamente a exposição à radiação ultravioleta, principalmente de forma cumulativa. Pacientes imunossuprimidos, que se submeteram a radiação ionizante, com cicatrizes de queimaduras, doenças dermatológicas inflamatórias crônicas e também com genodermatoses, como xeroderma pigmentoso, albinismo oculocutâneo e epidermólise bolhosa também possuem mais chance de desenvolver um CEC ao longo da vida.
A origem do CEC ocorre nas células escamosas da epiderme. O carcinoma espinocelular também pode ter diversas apresentações clínicas: placas eritematoescamosas, úlceras, nódulos verrucosos infiltrados e lesões que não cicatrizam e que sangram com facilidade. É importante a avaliação do dermatologista nesses casos, pois as lesões podem se assemelhar a verrugas, eczemas, psoríase, quando não são bem avaliadas pelo especialista, retardando o diagnóstico e tratamento do paciente.
O CEC evolui de modo mais rápido e agressivo que o CBC, podendo inclusive originar metástases locorregionais ou a distância em cerca de 3 a 7% dos casos. Porém, se tratado precocemente, tem um bom prognóstico, com altas taxas de cura.
Melanoma
O melanoma é uma neoplasia de pele e mucosas, que tem origem nos melanócitos. Dentre os principais tipos de câncer de pele, é o que tem pior prognóstico, porém quando identificado de maneira precoce, apresenta altas taxas de cura.
Os fatores de risco para seu desenvolvimento incluem: exposição à radiação ultravioleta, fototipos baixos, história familiar de primeiro grau, síndrome do nevo displásico e genodermatoses, como xeroderma pigmentoso.
O melanoma se manifesta, na maioria dos casos, como uma lesão pigmentada, assimétrica, de bordas irregulares, múltiplas cores, que pode evoluir com ulceração e sangramento. O tratamento precoce é fundamental devido o alto risco de metástase para órgãos à distância.
Quando suspeitar?
Existe uma regra prática para identificar lesões suspeitas pelo generalista, que favorecem o encaminhamento ao dermatologista: a regra ABCDE.
- A – Assimetria. Divide-se a lesão suspeita em 4 quadrantes e, quando a lesão possui assimetria nesses eixos, deve-se considerá-la uma lesão potencialmente de risco.
- B – Bordas irregulares. A presença de bordas irregulares na lesão também é um sinal de alerta.
- C – Cores. Lesões com múltiplas cores são consideradas suspeitas.
- D – Diâmetro maior ou igual a 6mm é sinal de suspeita.
- E – Evolução. Importante pista para o diagnóstico de lesões malignas, o crescimento de uma lesão, a mudança de cor ou formato, uma lesão que passa a sangrar ou ulcera também deve levantar o alerta.
Na dúvida, encaminhe o paciente ao dermatologista, para que uma avaliação mais detalhada possa ser feita e, se necessário, prosseguir uma biópsia de pele. Com o diagnóstico precoce, a grande maioria dos cânceres de pele têm uma alta taxa de cura.
Como prevenir?
A principal forma de prevenção do câncer de pele se dá através da fotoproteção. Algumas medidas, quando instituídas desde a infância, são capazes de reduzir efetivamente o risco de câncer de pele. Pessoas com história familiar de câncer de pele, fototipos baixos e hábitos de risco devem ser orientados quanto à importância da fotoproteção.
O uso de filtro solar é um aliado importante na prevenção do câncer de pele. Deve ser usado diariamente, com fator de proteção solar (FPS) de no mínimo 30, aplicado em quantidade adequada (uma colher de chá para o rosto) e reaplicado ao longo do dia.
Além do filtro solar, medidas como uso de roupas de proteção ultravioleta, chapéus, óculos escuros com proteção ultravioleta, evitar a exposição solar nos horários de maior risco (10 às 16 horas) devem ser incentivadas para a população.
Autor(a):
Vanessa Rolim Bessa Iepsen
Médica dermatologista formada pelo HCFMUSP ⦁ Título de especialista pela Sociedade Brasileira de Dermatologia
Geles hidroalcohólicos: ¿biocidas o cosméticos?
La Aemps ha elaborado una serie de consejos relativos al uso y a la conservación de estos productos, que pueden catalogarse de formas diferentes.

La Agencia Española de Medicamentos y Productos Sanitarios (Aemps) ha elaborado una serie de consejos relativos al uso y a la conservación de los geles y soluciones hidroalcohólicos para el lavado de manos.
Según la Aemps, “solo pueden garantizar su seguridad cuando se emplean siguiendo las condiciones de uso indicadas en su etiquetado“. Y añade: “Debido a su composición, es importante seguir las indicaciones de seguridad, prestar atención a su fecha límite de uso y mantenerlos fuera del alcance de los niños”.
Así pues, la agencia recuerda que los geles/soluciones hidroalcohólicos que hay en el mercado pueden pertenecer a la categoría de biocidas o de productos cosméticos.
Como especifica, los biocidas “deben incluir en su etiquetado la clasificación CLP, conforme al Reglamento 1272/2008, si alguno de sus ingredientes o una mezcla de ellos pueden ser clasificados como peligrosos; también deben especificar cuáles son las indicaciones y consejos que se deben tomar para evitar riesgos”. En estos casos, si son biocidas, deben incluir en su etiquetado un pictograma fácilmente identificable, que indique que pueden ser peligrosos y que son inflamables, ya que en su composición contienen un alto porcentaje de etanol. Además, deben establecer una serie de indicaciones de la naturaleza del riesgo y consejos para su uso y conservación. También, por este alto contenido en etanol, pueden provocar irritación ocular grave y son tóxicos en caso de ingestión.
Los geles o soluciones hidroalcohólicos de naturaleza cosmética pueden contener una cantidad muy variable de alcohol y no tienen la obligación de incluir esta información en su etiquetado. Pese a ello, la Aemps recomienda que se sigan las mismas precauciones que con los geles y soluciones hidroalcohólicos de naturaleza biocida y por eso ha establecido una serie de consejos para manipularlos correctamente y poder tomar las precauciones adecuadas para su conservación.
Entre estos consejos destacan los siguientes, que el farmacéutico conviene conocer y transmitir a los ciudadanos:
- Evitar aplicar geles y soluciones hidroalcohólicos en zonas sensibles o dañadas de la piel o mucosas.
- Mantener estos productos siempre alejados de focos de calor, como pueden ser superficies calientes, exposición solar directa, llamas abiertas, chispas o cualquier fuente de ignición.
- Evitar fumar inmediatamente después de usar estos geles o soluciones o en lugares donde estén almacenados.
- Almacenarlos en un lugar bien ventilado y fresco, evitando espacios donde se produzcan cambios de temperatura importantes.
- En caso de contacto con los ojos, aclararlos con abundante agua durante varios minutos. Si la irritación permanece, consultar con un médico.
- En caso de ingestión, llamar inmediatamente al Servicio de Información Toxicológica o acudir a un médico de urgencia.
Cuidado con los niños
Para la Aemps, los niños son “una población especialmente sensible a los riesgos de estos productos, dado que no son plenamente conscientes de cómo se deben utilizar ni del peligro que pueden suponer”. Además, afirma que, dada la proliferación de dispensadores comunitarios de geles y soluciones hidroalcohólicos, se ha detectado un creciente número de accidentes relacionados con estos dispensadores, siendo frecuentemente los niños los más afectados.
Por ello, y especialmente destinadas a la seguridad de la población infantil, hace hincapie en seguir las siguientes precauciones:
- Mantener los geles y soluciones hidroalcohólicos fuera del alcance de los niños.
- Supervisar siempre el uso de estos productos por parte de los más pequeños.
- En el caso de dispensadores comunitarios, tener en cuenta la altura de los mismos, ya que en numerosas ocasiones dispensan el producto a la altura de los ojos de los niños. Antes de utilizarlos, asegurarse de que no haya niños cerca.
- Tener siempre en cuenta el tipo de aplicador y la densidad del producto, ya que al dispensarlo en formato spray, es probable que el área de difusión sea mayor. De igual manera, cuanto menos denso sea el producto, mayor puede llegar a ser su alcance.
Keeping Eyes Safe From COVID-19: What Works?

Protection Goes Beyond Masking
Dr Anthony Fauci has suggested that eyewear such as goggles or face shields can offer more complete protection from the virus that causes COVID-19 than covering the nose and mouth alone. Although stopping short of a universal recommendation, Fauci advocates eyewear for those who want “perfect protection of the mucosal surfaces,” including the eyes. For the general public, eye protection is optional but could serve as an effective means to reduce the risk for COVID-19, depending on the environment.
It’s a different story for healthcare providers (HCPs) in many clinical settings, where eye protection recommendations depend on the likelihood of exposure in the direct care of patients. In its updated guidance, Interim Infection Prevention and Control Recommendations for Healthcare Personnel During the Coronavirus Disease 2019 (COVID-19) Pandemic, the Centers for Disease Control and Prevention (CDC) recommends eye protection for the following HCPs:
- Those caring for patients with suspected or confirmed SARS-CoV-2 infection; and
- Those working in facilities located in areas with moderate to substantial community transmission who are more likely to encounter asymptomatic or presymptomatic patients with SARS-CoV-2 infection.
In addition to wearing a mask when caring for a patient with suspected or confirmed COVID-19, the CDC recommends goggles or a face shield that covers the front and sides of the face, rather than safety glasses or standard prescription eyeglasses, which, by design, offer limited protection from splashes, sprays, and airborne particles.
The CDC doesn’t address the risk for infection with SARS-CoV-2 from coworkers or the general public beyond these two clinical scenarios, leaving HCPs to decide for themselves whether and what type of eye protection they should wear at or outside the workplace and the potential benefits of doing so.
Why Worry About the Eyes?
Given that COVID-19 cases and deaths continue to climb, it’s clear that we don’t perfectly understand all modes of transmission, including the role of the eyes.
The eye, like the nose and mouth, is a mucous membrane that might serve as a portal for acquisition of SARS-CoV-2 by providing a large surface area exposed to droplets or airborne particles and contamination from a person’s hands. The surface of the eye is thought to contain SARS-CoV-2 ACE receptors, which bind to the virus. The virus has been isolated in tears and other conjunctival secretions, and like other viruses, it can be carried down via the nasal-lacrimal duct into the nasopharynx and into the lungs. Moreover, conjunctivitis can be the presenting sign of COVID-19.
Which of the many available eyewear options significantly reduce the risk for viral transmission? Let’s review the evidence.
Prescription Eyeglasses
Early in the pandemic, doctors in China made a curious observation about COVID-19 patients admitted to their intensive care unit. Very few of these patients routinely wore prescription eyeglasses, suggesting that glasses might have a role in protecting the wearer from the virus that causes COVID-19. Their observations were confirmed in a cohort study of patients admitted to the hospital with a diagnosis of COVID-19. Inpatients with COVID-19 were significantly less likely than the general population (5.8% vs 31.5%, respectively) to wear glasses for at least 8 hours daily.
This significant disparity suggests a protective effect of full-time eyeglass wear against the acquisition of SARS-CoV-2, possibly by serving as a barrier to droplet and ocular surface transmission if worn when directly interacting with others. The findings of this small study, while certainly intriguing, are far from conclusive, and a prospective study would be needed to prove that glasses can guard against COVID-19.

Standard eyeglasses protect only the front of the eye, so airborne viruses, droplets, or splashes can reach the eyes from the top, bottom, or sides of the glasses. Poorly fitting or loose glasses might encourage more handling of eyewear, with potential contamination from the wearer’s hands.
Safety Glasses
Like standard eyeglasses, safety glasses (also known as trauma glasses) provide a relatively low level of protection against respiratory droplets. Safety glasses are primarily designed to protect the wearer from high-velocity impact and exposure to radiation and chemicals. The American National Standards Institute (ANSI) regulates the standards for this type of eyewear, with ANSI Z87.1 being the standard rating for eye and face protection. Note, however, that this rating does not include protection against bloodborne pathogens or other types of infection control.

Like prescription eyeglasses, many safety glasses are designed with gaps between the frame and the face, which may fail to block transmission of infection through sprays, splashes, or airborne particles circulating in poorly ventilated environments. This exposure point can be minimized with side shields or a wraparound design.
Plano safety glasses can be worn over prescription glasses and will probably provide some protection. Some safety glasses can be customized with prescription lenses to eliminate the need for multiple pieces of eyewear.

Goggles
By creating a seal around the eyes, goggles can dramatically reduce the access of the virus to the ocular surface by offering protection against sprays or splashes of respiratory droplets.
This effectiveness may depend on the style of the goggles. Goggles are available with different degrees of ventilation, which cuts down on fogging. Direct-vented goggles allow unimpeded airflow and also may allow penetration by sprays and splashes. Indirect-vented goggles may block liquid splashes but could still allow small airborne particles to penetrate. Nonvented goggles offer the highest level of infection by blocking airborne particles as well as sprays or splashes.

Some goggles can fit over prescription glasses, but it is important to check for any gaps between the edge of the goggles and the face.
Goggles are currently recommended for providers interacting with COVID-19 patients or working in areas with moderate to substantial SARS-CoV-2 transmission. Typically a nondisposable item, goggles should be removed after leaving an infected patient’s room, and cleaned and disinfected prior to next use. In areas with minimal or no community spread, goggles are considered optional unless otherwise indicated.
Unvented goggles (along with a face mask) would probably also offer the highest level of protection for anyone spending a long period of time with people in a poorly ventilated environment.
Face Shields
Face shields may be worn in conjunction with or as an alternative to eyeglasses, safety glasses, or goggles. Face shields worn with goggles provide the maximum level of eye protection. By themselves, face shields mainly block direct droplet sprays.
Face shields reduce exposure of the mucous membranes, including those of the eyes, mouth, and nose, to the virus. To provide optimal eye protection from viral transmission, face shields should cover the crown and chin and extend to the ears.
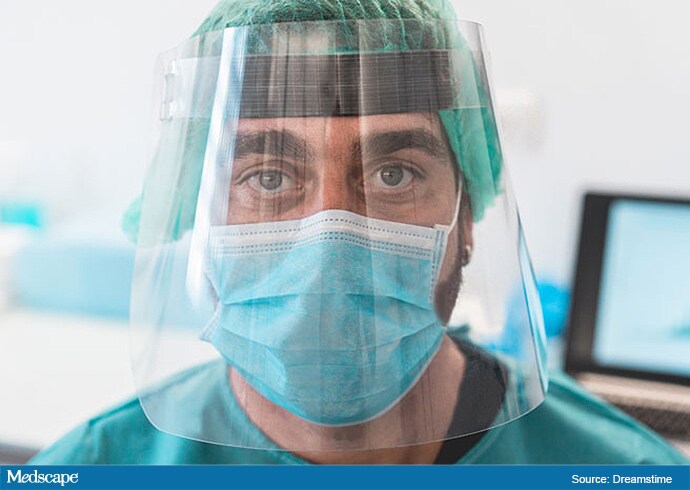
Face shields are considered an appropriate form of eye protection in areas with moderate to substantial SARS-CoV-2 transmission.
Contact Lenses
Questions have been raised about whether contact lenses can act as a shield against the transmission of SARS-CoV-2. On the flipside, there are fears that contact lenses could serve as reservoirs for the virus. Contact lenses could also potentially promote the spread of SARS-CoV-2 by increasing the frequency and intensity of hand contact with the ocular surface.
It is unlikely that contact lenses offer any meaningful protection from infection because they are covered by the tear film, which is the eye’s first line of defense. Soft contact lenses more fully cover the cornea than hard lenses and thus might serve as a mechanical barrier to the eye’s SARS-CoV-2 ACE 2 receptors. However, the receptor density is low overall, and the tear film could still spread virus particles to the cornea and conjunctiva.
Nor is it likely that contact lenses play a significant role in promoting the spread of the virus as long as standard contact lens hygiene practices are followed. Contact lens wearers do tend to rub their eyes more often than the general population, which might serve as another route of infection of the eyes.
Patients with COVID-19 should refrain from wearing contact lenses while sick. Any soft contact lenses worn when the patient was positive for the virus should be discarded; hard contact lenses should be sterilized.
There is no compelling evidence regarding specific contact lens materials and virus susceptibility, but in general, daily disposable lenses are the most effective at reducing inflammatory complications.
Choosing Eye Protection
Formal eye protection recommendations have been made for HCPs who are caring for COVID-19 patients in clinical settings, but other scenarios fall into a gray area.
If ventilation of the area is a concern or the level of ventilation in one’s workspace is unknown, then goggles would provide the highest level of eye protection, as they protect from airborne particles that may circulate for longer in a poorly ventilated area.
When interacting with other people where the level of contact is casual and social distancing is followed, eyeglasses or safety glasses would provide some level of eye protection from an unexpected sneeze or cough that could transmit SARS-CoV-2. The level of protection offered by eyeglasses or safety glasses is not robust, but they do provide at least some barrier to viral transmission.
Best Practices for Eyewear Removal
When eyeglasses or safety glasses are removed, the wearer should touch only the portion of the glasses that secures them to the head. The front of the glasses is the area most likely to be contaminated, so touching that area should be avoided. Safety glasses should be disinfected according to the manufacturer’s instructions and allowed to air-dry.
Goggles should be removed by touching the back strap, not the front or sides of the goggles.
The Evolving Role of Eye Protection
The precise role of eye protection is evolving. Although goggles and face shields provide high levels of eye protection from SARS-CoV-2 in the workplace, the evidence is less clear when it comes to safety glasses, standard eyeglasses, and contact lenses. Future studies will certainly attempt to determine the most effective form of eye protection for HCPs in the clinical setting.
In addition to HCPs facing an obvious risk for exposure to the virus and more severe COVID-19 illness in the workplace, recent evidence suggests that the risks are also significant during social or family gatherings.
There is no question that the eyes pose a risk, at least theoretically, of serving as a gateway for infection with SARS-CoV-2, and they may even exhibit conjunctivitis, a presenting sign of the virus. In the absence of universal recommendations for protective eyewear during the pandemic, clinicians must decide for themselves how much protection they desire, both inside and outside the healthcare setting.
Brianne N. Hobbs, OD, is associate director of exam innovation at the National Board of Examiners in Optometry in Charlotte, North Carolina. She is currently engaged with the creation of a new clinical skills exam for optometry. She has spent most of her career in academia and has also worked in a hospital-based setting.
Medscape Ophthalmology © 2020 WebMD, LLC
Any views expressed above are the author’s own and do not necessarily reflect the views of WebMD or Medscape.
Cite this: Keeping Eyes Safe From COVID-19: What Works? – Medscape – Dec 16, 2020.
La liste des médicaments à l’origine de nécrolyses épidermiques s’allonge

Virtuel – A l’occasion des Journées Dermatologiques de Paris (J DP 2020), le Dr Thomas Bettuzzi (CHU Henri Mondor, Créteil) a présenté les résultats d’une étude de pharmacovigilance ayant mis en évidence l’implication de nouveaux médicaments dans la survenue des nécrolyses épidermiques. Deux groupes de médicaments sont particulièrement représentés : les antiépileptiques et les anticancéreux.
La nécrolyse épidermique est la plus sévère des allergies médicamenteuses. Elle se caractérise par un décollement muqueux et cutané. Si elle reste rare (6,5 cas /million/ an), elle est particulièrement grave puisque la mortalité est de 15 à 30 % en phase aiguë. Dans 85% des cas, il s’agit d’une réaction retardée à un médicament inducteur dont l’arrêt précoce est associé à un meilleur pronostic.
Cela explique l’importance de caractériser les médicaments associés à cette toxidermie.
Augmentation des signaux et nouveaux médicaments
Le Dr Bettuzzi a mené une étude de pharmacovigilance à partir de VigiBase , la base de données de l’OMS. Il a sélectionné tous les patients pour lesquels les rapports de sécurité individuels (RSI) mentionnaient les termes « Stevens Johnson Syndrome », « Toxic Epidermal Necrolysis » ou « SJS-TEN overlap ».
Il a distingué deux périodes. La première 1997-2001 correspond à la période d’inclusion d’EuroSCAR. Publiés en 2008, ses résultats étaient jusqu’à présent les derniers disponibles identifiant les médicaments en cause dans la nécrolyse épidermique (NE). La seconde période d’étude couvre les cinq dernières années, 2016-2020. L’âge médian des patients, plutôt des femmes, est de 40 ans.
Entre 1997 et 2001, environ 4000 de NE ont été rapportés, principalement en Europe et sur le continent américain. 72 médicaments ont été identifiés comme associés à la survenue d’une NE sur les 299 rapportés.
Entre 2016 et 2020, environ 13000 cas ont été rapportés dont la majorité provenait d’Asie. Sur les 621 médicaments suspectés, 114 ont été identifiés comme associés à la survenue d’une NE. SI le Dr Bettuzzi a retrouvé des médicaments précédemment identifiés, 67 médicaments (soit 59 %) étaient nouvellement associés, aux premiers rangs desquels on trouvait des antiépileptiques et des psychotropes, et des anticancéreux. Thomas Bettuzzi a détaillé les molécules issues de ces deux groupes de médicaments lors de la session « Allergologie et Toxidermies » des JDP.
Quels sont les principaux médicaments associés à la NE ?
Les anti-épileptiques
- la phénytoïne *
- la carbamazépine *
- la lamotrigine *
- le phénobarbital *
- le zonisamide **
- l’oxcarbazépine **
- le levetiracetam **
- le modafinil **
*anciennement identifiés et confirmés par la nouvelle étude
** nouvellement identifiés
Les anticancéreux
1-les molécules d’immunothérapie :
- le mogamulizumab
- le pembrolizumab
- le nivolumab
- l’ipilimumab
2-les inhibiteurs de tyrosine kinase :
- le cobimétinib
- le vémurafénib
- l’idélalisib
- le régorafénib
Tous ces médicaments anticancéreux ont fait l’objet d’un rapport au cours de la période la plus récente.
Le cas des anti-inflammatoires
Quelle est l’implication des anti-inflammatoires dans la survenue des NE ? Il s’agit d’un biais propre aux bases de données de pharmacovigilance. « Les anti-inflammatoires et les analgésiques peuvent être administrés dès les premiers signes de l’éruption et donc être associés alors qu’ils ne sont pas responsables » a expliqué le Dr Bettuzzi. On parle de biais protopathique.
Reste que le recours à une base de données internationale mise à jour quotidiennement permet une détection très rapide des signaux grâce à des effectifs très larges malgré la rareté de la maladie.
Les résultats d’association des différents médicaments à la NE doivent être confirmés par des études en pharmaco-épidémiologie.
Actualités Medscape © 2020 WebMD, LLC
Citer cet article: La liste des médicaments à l’origine de nécrolyses épidermiques s’allonge – Medscape – 17 déc 2020.
Antihistamine Prescribing for AD Varies by Specialty

Dermatologists are more likely than are nondermatologists to follow practice guidelines when prescribing antihistamines to treat pruritus associated with atopic dermatitis (AD), according to an analysis of a national database.
The American Academy of Dermatology’s guidelines on AD management recommend against using antihistamines, particularly the nonsedating variety, to treat pruritus, but “sedating antihistamines may still be used to help alleviate negative impacts on sleep … particularly in pediatric populations,” Swati Garg, BA, and associates at Northwestern University, Chicago, wrote in Pediatric Dermatology.
Dermatologists were more likely to prescribe sedating than nonsedating antihistamines (0.68 vs. 0.32) for patients with AD, but the reverse applied to nondermatologists, whose antihistamine distribution was 0.23 sedating and 0.77 nonsedating, based on 2011-2016 data from the National Ambulatory Medical Care Survey.
The numbers were similar for new antihistamine prescriptions, with sedating/nonsedating proportions of 0.60/0.40 for dermatologists and 0.24/0.76 for nondermatologists. Addition of guideline-recommended drugs such as topical corticosteroids and calcineurin inhibitors to the AD equation did not change the result, as dermatologists again showed a preference for sedating antihistamines, compared with nondermatologists, the investigators said.
The data also showed that Black patients with AD were more likely than were White patients to receive prescriptions for first-generation antihistamines and for therapies recommended by the AAD guidelines, and that patients under 21 years received more sedating antihistamines than did patients over age 21, they reported.
The age disparity “may be due to patient preference, as sedation effects may be less desirable to adult patients,” the investigators noted.
SOURCE: Garg S et al. Pediatr Dermatol. 2020 Nov 27. doi: 10.1111/pde.14445.
This article originally appeared on MDedge.com, part of the Medscape Professional Network.
Medscape Medical News © 2020 WebMD, LLC
Cite this: Antihistamine Prescribing for AD Varies by Specialty – Medscape – Dec 15, 2020.
Toallitas ‘eco’ y dispositivos sónicos para dejar rostros inmaculados
Retirar el maquillaje y realizar la limpieza facial son rutinas que cada vez son más cómodas y sencillas gracias al lanzamiento de nuevos cosméticos y de productos complementarios.

No hay excusas para irse a la cama sin desmaquillarse o sin hacer una adecuada limpieza facial. Y es que la industria cosmética está desarrollando productos innovadores que están facilitando esta rutina, incluso para las personas más perezosas, y que pueden ser recomendados por los farmacéuticos.
Pero antes de analizar por dónde va esta innovación, expertos consultados por este periódico afirman que hay que dejar claro previamente que desmaquillarse no es lo mismo que limpiar la piel facial. De hecho, los desmaquilladores están formulados para eliminar productos como la base, la sombra de ojos y la máscara de pestañas, mientras que una buena limpieza se debe realizar cuando ya no hay maquillaje en la cara. Incluso, aunque se tenga la sensación de limpieza con el primer paso, no se debe obviar el segundo.
Elena Manubens, miembro del Grupo Español de Dermatología Estética y Terapéutica de la Academia Española de Dermatología y Venereología (AEDV), destaca la importancia de que la piel para su correcto funcionamiento debe estar limpia porque no está diseñada para tener ningún producto encima que la obstruya.
“Hay que tener presente que cualquier producto, incluso un protector solar –que nos va a aportar beneficios–, altera el funcionamiento de nuestra piel: son moléculas que pueden obstruir las glándulas grasas que nos hidratan o provocar una irritación cutánea si permanece mucho tiempo en la piel. Por tanto, debemos limpiarnos la cara a diario”, aconseja.
Por su parte, Gema Herrerías, vocal de Dermofarmacia del Consejo Andaluz de Colegios de Farmacéuticos, va más allá y señala que “el proceso de limpieza es muy importante, ya que si es deficiente se puede alterar el equilibrio de la piel con la microbiota y, además, la flora saprófita puede degradar la suciedad acumulada causando mal olor”. Además, “una piel que no esté limpia –añade– obtendrá menor eficacia de los cosméticos que esté empleando”.
Nuevos formatos
Hecha esta aclaración, se puede afirmar que, al igual que el campo de los cosméticos y maquillajes está repleto de novedades, el de productos para desmaquillar también, aumentado tanto en el tipo de formulación (geles, espumas, aceites, bálsamos, adaptados para diferente tipo de pieles) como en el formato en el que se presenta.
Así, destacan los discos ecológicos, lavables y reutilizables, las toallas y esponjas desmaquillantes que retiran los restos de maquillaje con solo humedecerlas en agua; y los lápices de labios limpiadores, que eliminan el carmín de larga duración.
Las toallitas, clásico
Sin embargo, un producto que sigue teniendo un hueco importante en las estanterías de los baños de muchas mujeres son las toallitas desmaquillantes. Éstas suelen estar compuestas principalmente por agentes surfactantes que disuelven la suciedad y otros agentes emulsificantes que arrastran los restos de maquillaje, sebo, suciedad…
La principal ventaja está clara: su sencillez de uso y comodidad. Entre sus principales inconvenientes, las expertas señalan que limpian la cara de forma superficial y, al no existir un aclarado en el proceso, pueden dejar algunos residuos en la piel que terminan desencadenando alergias. Además, están contraindicadas para pieles sensibles, dermatitis atópica y rosáceas y son muy contaminantes.
Las novedades en este producto las protagonizan las toallitas que ya se venden impregnadas de agua micelar y compuestas por fibras de seda, las que son completamente biodegradables y las compuestas por algodón orgánico.
A juicio de Gema Herrerías, lo más importante a la hora de elegir los productos cosméticos adecuados para la higiene facial es tener en cuenta “el tipo y el estado de piel (si es grasa, normal o es muy seca y presenta descamación) y las preferencias del usuario como, por ejemplo, los hábitos de higiene matinal, si se aplica o no maquillaje, si prefiere el producto que se aclara con agua… Dada la variedad de productos cosméticos que existen en el mercado, todos los tipos de piel pueden beneficiarse de las distintos rutinas de limpieza”.
Productos adecuados y cómodos
“La comodidad es la clave”, asegura Manubens. “Las personas tienen que elegir entre los productos que se adecúen a su piel, aquellos que les sean cómodos y no les complique su rutina. El cumplimiento en la limpieza facial es esencial; por eso debe ser sencillo, sobre todo para las usuarias a las que les da más pereza desmaquillarse, como pueden ser las adolescentes”.
Otra forma de desmaquillarse que también se ha abierto un hueco importante en los hábitos de la limpieza facial es el que se lleva a cabo a través de dispositivos sónicos, que se usan normalmente con geles, aunque, según la dermatóloga, se deben utilizar con mucha precaución, porque no están indicados para todas las personas. “Estos aparatos pueden producir dermatitis irritativas por exceso en la limpieza –advierte–, ya que suelen eliminar la parte más superficial de la piel, dejando la cara muy sensibilizada y expuesta”.
“Hay pieles que lo aguantan bien y otras incluso a las que les puede beneficiar porque tienen pieles grasas con obstrucciones del poro y necesitan una limpieza extra, pero en general -añade la dermatóloga- las exfoliaciones físicas no se deben utilizar a diario porque pueden agredir a la piel”. En definitiva, depende de la grasa que nuestras glándulas sebáceas sean capaces de fabricar y que constituyen la barrera natural protectora de nuestra piel.
Los básicos
Centrándonos en los básicos de la limpieza facial, en el caso de las personas que se maquillan, la portavoz de la AEDV destaca que la limpieza debe pasar por elegir un desmaquillante adaptado a cada piel y al maquillaje utilizado y, posteriormente, utilizar un limpiador para eliminar los restos del producto desmaquillante. “Con un simple jabón sería suficiente”, dice.
La farmacéutica especialista en Dermocosmética especifica que, por la mañana, no debe faltar una emulsión limpiadora, una espuma o un gel limpiador para eliminar los restos de secreciones cutáneas (grasas, corneocitos y sudor) y de cosméticos que se han aplicado y acumulado durante la noche. Y por la noche, Herrerías recomienda la limpieza en dos pasos: primero con un limpiador y desmaquillante al aceite, que arrastre bien todos los restos de maquillaje, y después aplicar una solución micelar como segundo paso. En caso de utilizar agua para un aclarado final, recomienda que sea “agua tibia, entre 25º y 30º, pero en ningún caso caliente para evitar irritar la piel”.
“Es esencial asegurarse de que no queden residuos de maquillaje ni de protector solar, que son los más resistentes al sudor y al agua, así como de aquellos procedentes de la contaminación ambiental para dejar la piel completamente limpia”, incide.
En cuanto al tipo de cosméticos a utilizar, Herrerías indica que “en las pieles grasas el exceso de secreción sebácea se retira más eficazmente con productos limpiadores líquidos jabonosos, mientras que, en las secas o deshidratadas, los más indicados son las emulsiones limpiadoras o los limpiadores al aceite”.
La adolescencia, el pistoletazo de salida
Una duda habitual suele ser la edad a la que empezar a limpiar la cara. Para Manubens esto va a depender de lo que se aplique sobre la piel facial. “Si es una piel normal y no se aplica nada externo, no hace falta limpiarla porque ella sola se limpia y se autorregula. Pero si aplicamos cualquier producto externo siempre hay que retirarlo”.
Por otro lado, hay etapas de la vida en la que la piel no termina de regularse bien porque tiene un exceso de grasa, como puede ser en la adolescencia; habría que limpiarla bien desde entonces. “Pero la regla es que depende de lo que apliques en tu piel y, según la alteres, así debes profundizar más o menos en su limpieza. Por ejemplo, un niño que solo utilice protector solar, con agua y jabón en su baño diario es más que suficiente”.
Para Herrerías, los hábitos de higiene deben instaurarse desde la infancia como parte de la educación sanitaria. “La piel actúa como una barrera protectora frente a los agentes externos vivos y, por ello, debe mantenerse en condiciones óptimas. En la adolescencia, cuando las chicas comienzan a emplear maquillaje, además de limpiar la piel es necesario desmaquillarla bien por las noches”.
Problemas dermatológicos
Pese a los beneficios que aporta una buena limpieza facial, ambas expertas recuerdan que tanto los productos desmaquillantes como los limpiadores, si no se usan bien o no son los adecuados, pueden causar problemas dermatológicos. El más frecuente en relación a los productos de higiene y desmaquillado es el empleo de cosméticos que contienen tensoactivos limpiadores irritantes para la piel y para los ojos.
No obstante, son problemas que se deben evaluar de forma individual, ya que van a depender del comportamiento del activo en solución acuosa, la concentración que incluya la formulación, el pH del producto terminado y la susceptibilidad de cada persona.
¿El agua miscelar se debe aclarar?
Uno de los debates en temas de limpieza facial es sobre el uso de las aguas micelares y su recomendación o no de aclarado. Para poder llegar a un acuerdo, Gema Herrerías, vocal de Dermofarmacia del Consejo Andaluz de Colegios de Farmacéuticos, destaca que es importante conocer la composición del agua micelar y sus funciones.
En ese sentido, hay que saber cuáles son las funciones de los tensoactivos que contiene el agua micelar y los otros ingredientes que están presentes en su composición con propiedades humectantes, hidratantes o astringentes. A su juicio, la necesidad de aclarar o no una solución micelar depende, principalmente, de las recomendaciones del fabricante porque no todas son iguales.
En cuanto a establecer el cuándo y el cómo de su uso, “se pueden utilizar como único producto por la mañana y por la noche pero, en ese caso, habría que tener en cuenta que se requiere mucha cantidad y tiempo de aplicación para que el proceso sea lo suficientemente eficaz. En caso contrario, es mejor utilizarlas como segundo paso de la doble limpieza”, explica la experta.
Ana Molina, dermatóloga de la Fundación Jiménez Díaz y divulgadora, coincide en que el aclarado depende de las especificaciones de cada producto, pero sostiene que “lo ideal cuando usamos agua micelar o cualquier producto para limpiar nuestra cara o desmaquillarnos es luego retirarlo con agua. Se use el que se use, no debemos olvidar que, al menos una vez al día, debemos hacer una limpieza facial que incluya agua”.
Daily Sunscreen Prevents More Melanoma Deaths vs Early Detection

The dramatic advances in targeted therapies for late-stage melanoma capture the headlines, but a recent Australian study quietly concluded that the most cost-effective way to lower both the incidence of melanoma and deaths caused by the malignancy over the long haul is through primary prevention in the form of daily sunscreen use, according to Laura Korb Ferris, MD, PhD, a dermatologist and director of clinical trials in the department of dermatology at the University of Pittsburgh.
“I think it’s really important that we recognize the importance of preventing skin cancer, and not just early detection, not just treatment of late disease,” Ferris said at a virtual forum on cutaneous malignancies jointly presented by Postgraduate Institute for Medicine and Global Academy for Medical Education.
She highlighted the Australian cost-effectiveness analysis, which used Markov modeling of data from two published population-based, randomized controlled trials carried out in Queensland, Australia.
The cost-effectiveness study compared the estimated long-term impact of three different approaches to control of melanoma: a primary prevention strategy, which basically consisted of promoting daily sunscreen use and other forms of sun protection; early detection through annual whole-body skin examinations by physicians starting at age 50; and no intervention. The analysis provided estimates of the number of cases of melanoma, deaths caused by melanoma, nonmelanoma skin cancers, and quality of life outcomes over the course of 30 years starting in 50-year-old men and women.
Primary prevention through sun protection was the clear winner, as shown by the results:
- A 44% reduction in the incidence of melanoma, compared with early detection via annual physician skin examinations.
- A 39% reduction in projected melanoma deaths compared with early detection, which in turn achieved only a 2% reduction when compared with no intervention.
- 27% fewer keratinocyte cancers excised than with annual skin examinations.
- A 21.7% reduction in societal costs, compared with an early-detection program.
Daily sunscreen use for primary prevention was also associated with a modest 0.1% increase in quality-adjusted life-years. “Prevention is low cost, low risk, and effective,” Ferris observed.
The investigators noted that, while residents of the Australian state of Queensland are mainly fair-skinned and confront high UV radiation levels throughout the year, somewhat limiting the generalizability of the study findings, the relationships between the costs of interventional strategies and their outcomes should be proportional in other countries.
True enough, but a strategy of annual skin examinations starting at age 50 years as modeled in the Australian study is not the most productive way to conduct a melanoma early-detection program, Ferris said. She noted that data from the National Cancer Institute’s Surveillance, Epidemiology, and End Results Program show that the median age at diagnosis of melanoma in the United States is 65 years, while the median age at death caused by the malignancy is 71 years. That information is helpful in formulating strategies to improve early detection through more focused, higher-yield screening.
Case in point: European investigators have estimated that, by screening everyone age 50 years and older, 475 people need to be screened and an average of 19.6 lesions must be biopsied in order to detect one melanoma. But by reserving screening for those age 50 years and up who have any one of three risk factors – a personal history of melanoma, atypical nevi, or at least 40 common nevi – those numbers drop dramatically: 98 people need to be screened and 13.5 lesions biopsied to detect one melanoma. And by further narrowing the screened population to those age 65 years or older with any of the three risk factors, 63 seniors would need to be screened and 9.2 lesions excised to find one melanoma.
Total-body skin examinations are time-consuming for dermatologists. In a recent U.S. study, investigators determined that the additional face-to-face time required per skin cancer detected by doing a total-body skin exam in adults who present to a dermatologist for another reason is 4.5 hours. And that’s just the time involved in detecting any type of skin cancer.
“To get that number for melanoma, multiply by 15 to 20,” Ferris said.
The investigators also determined that, for each decade of advancing age and increment in lighter skin phototype, the number-needed-to-examine in order to identify one skin cancer of any type decreased.
“By focusing on patients who are older and have fair skin types we can get that time down to about 1 hour,” commented Ferris, who penned an editorial perspective on the study.
While many dermatologists recommend that people with a high common nevus count undergo frequent screening for melanoma because they are at particularly high risk for invasive disease, a couple of recent studies challenge that notion, she pointed out. One was a retrospective study of 326 consecutive new melanoma patients which found that patients with a higher nevus count had thinner melanomas and a greater likelihood of in situ melanoma. Patients who presented with invasive melanoma had a mean total nevus count of 31.5 lesions, while those with in situ melanoma averaged 57.2 nevi. Each additional nevus was associated with a 4% reduction in the likelihood of invasive melanoma, independent of age and sex.
The other study included 566 newly diagnosed melanoma patients in two U.S. centers. Among the 56% of patients who were younger than 60 years, those who had more than 50 total nevi were 68% less likely to have a thick melanoma in a logistic regression analysis that controlled for demographic factors, as well as anatomic location of the melanoma, histologic subtype, and skin cancer screening frequency. In contrast, younger patients with more than 5 atypical nevi were 2.43-fold more likely to have thicker melanomas than were those with no such lesions. The lesson, according to the investigators, is that total nevus count isn’t a reliable determinant of a patient’s risk status or the need for skin examinations.
Ferris reported no financial conflicts of interest regarding her presentation.
Global Academy for Medical Education and this news organization are owned by the same company.
This article originally appeared on MDedge.com, part of the Medscape Professional Network.
Medscape Medical News © 2020 WebMD, LLC
Cite this: Daily Sunscreen Prevents More Melanoma Deaths vs Early Detection – Medscape – Dec 03, 2020.
COVID-19: Hand Sanitizer Poisonings Soar, Psych Patients at High Risk

Cases of poisoning — intentional and unintentional — from ingestion of alcohol-based hand sanitizer have soared during the COVID-19 pandemic.
In the United Kingdom alone, alcohol-based hand sanitizer poisonings reported to the National Poisons Information Service (NPIS) jumped 157% — from 155 between January 1 and September 16, 2019, to 398 between January 1 and September 14, 2020, new research shows.
More needs to be done to protect those at risk of unintentional and intentional swallowing of alcohol-based hand sanitizer, including children, people with dementia/confusion, and those with mental health issues, according to Georgia Richards, DPhil student, Centre for Evidence-Based Medicine, Nuffield Department of Primary Care Health Sciences, University of Oxford, England.
“If providers are supplying alcohol-based hand sanitizers in the community to reduce the spread of SARS-CoV-2, the contents should be supplied in lockable and automated dispensers to reduce contamination and improve safety,” Richards told Medscape Medical News.
The study was published online December 1 in BMJ Evidence-Based Medicine.
European, US Poisoning Rates Soar
In the paper Richards describes two deaths that occurred in hospitals in England.
In one case, a 30-year-old woman, detained in a psychiatric unit who received the antidepressant venlafaxine was found dead in her hospital bed with a container of hand-sanitizing gel beside her.
“The gel was readily accessible to patients on the ward from a communal dispenser, and patients were allowed to fill cups or other containers with it to keep in their rooms,” Richards reports.
A post-mortem analysis found a high level of alcohol in her blood (214 mg of alcohol in 100 mL of blood). The medical cause of death was listed as “ingestion of alcohol and venlafaxine.” The coroner concluded that the combination of these substances suppressed the patient’s breathing, leading to her death.
The other case involved a 76-year-old man who unintentionally swallowed an unknown quantity of alcohol-based hand-sanitizing foam attached to the foot of his hospital bed.
The patient had a history of agitation and depression and was treated with antidepressants. He had become increasingly confused over the preceding 9 months, possibly because of vascular dementia.
His blood ethanol concentration was 463 mg/dL (100 mmol/L) initially and 354 mg/ dL (77mmol/L) 10 hours later. He was admitted to the intensive care unit, where he received lorazepam and haloperidol and treated with ventilation, with a plan to allow the alcohol to be naturally metabolized.
The patient developed complications and died 6 days later. The primary causes of death were bronchopneumonia and acute alcohol toxicity, secondary to acute delirium and coronary artery disease.
Since COVID-19 started, alcohol-based hand sanitizers are among the most sought-after commodities around the world. The volume of these products — now found in homes, hospitals, schools, workplaces, and elsewhere — “may be a cause for concern,” Richards writes.
Yet, warnings about the toxicity and lethality of intentional or unintentional ingestion of these products have not been widely disseminated, she notes.
To reduce the risk of harm, Richards suggests educating the public and healthcare professionals, improving warning labels on products, and increasing the awareness and reporting of such exposures to public health authorities.
“While governments and public health authorities have successfully heightened our awareness of, and need for, better hand hygiene during the COVID-19 outbreak, they must also make the public aware of the potential harms and encourage the reporting of such harms to poisons information centers,” she notes.
Increases in alcohol-based hand sanitizer poisoning during the pandemic have also been reported in the United States.
The American Association of Poison Control Centers (AAPCC) reports that data from the National Poison Data System (NPDS) show 32,892 hand sanitizer exposure cases reported to the 55 US poison control centers from January 1 through November 15, 2020 — an increase of 73% compared with the same time period during the previous year.
An Increase in Self-Harm
Weighing in on this issue, Robert Bassett, DO, associate medical director of The Poison Control Center at Children’s Hospital of Philadelphia, Pennsylvania, told Medscape Medical News that “cleaning agents and disinfectants have been around for eons and their potential for toxicity hasn’t changed.”
“Now with COVID, and this hyper-vigilance when it comes to cleanliness, there is increased access and the exposure risk has gone up,” he said.
“One of the sad casualties of an overstressed healthcare system and a globally depressed environment is worsening behavioral health emergencies and, as part of that, the risk of self-harm goes up,” Bassett added.
“The consensus is that there has been an exacerbation of behavioral health emergencies and behavioral health needs since COVID started and hand sanitizers are readily accessible to someone who may be looking to self-harm,” he said.
This research had no specific funding. Richards is the editorial registrar of BMJ Evidence Based Medicine and is developing a website to track preventable deaths. Bassett has disclosed no relevant financial relationships.
BMJ Evid Based Med. Published online December 1, 2020. Full text
Medscape Medical News © 2020
Cite this: Megan Brooks. COVID-19: Hand Sanitizer Poisonings Soar, Psych Patients at High Risk – Medscape – Dec 02, 2020.