Cardiologia
« Le cœur à l’oeil » ou Salves de tachycardie atriale rapides induites par un analogue de la prostaglandine F2a en collyre
Patrick DAUDON et coll*, service de cardiologie du CHR d’Orléans
Un patient de 70 ans, médecin à la retraite qui continue à exercer, ressent soudainement un léger étourdissement indéfinissable lors d’une discussion véhémente.
Observation
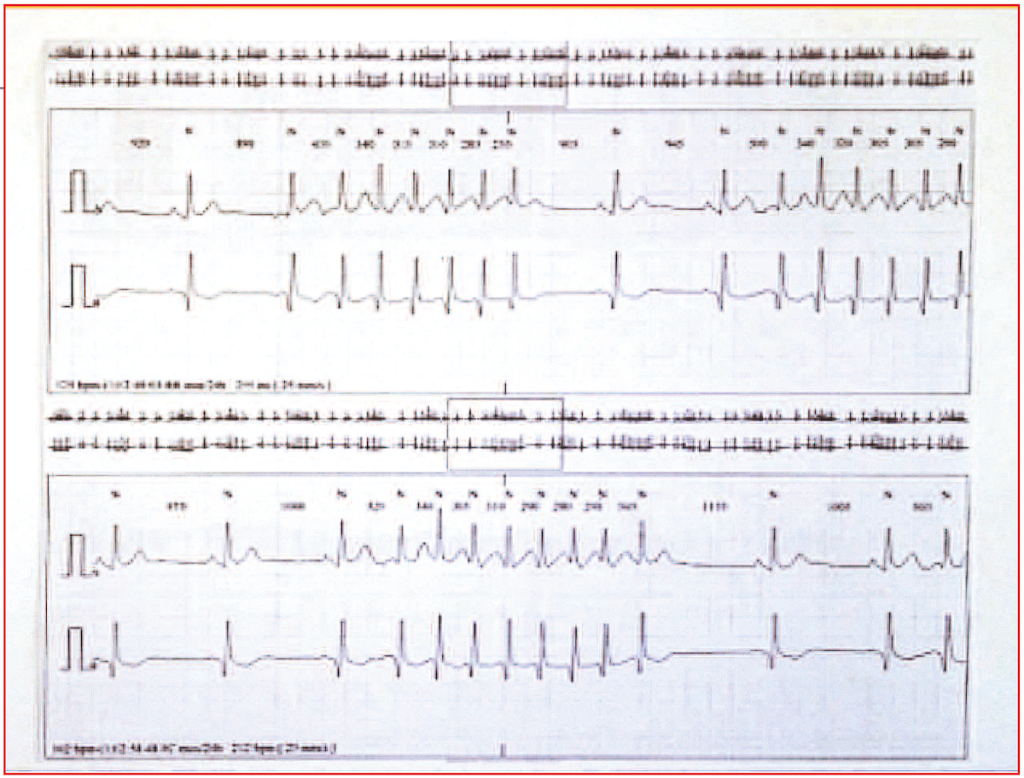
Ce patient de 70 ans, médecin à la retraite qui continue à exercer, ressent soudainement un léger étourdissement indéfinissable lors d’une discussion véhémente. En s’examinant, il note une arythmie cardiaque nette isolée. L’ECG confirme l’arythmie (figure 1) avec des salves de tachycardie atriale (TA) brèves, rapides (de 150 à 190/min), de 4 à 10 complexes avec retour en rythme sinusal sur 1 à 2 complexes, ainsi de suite. L’échocardiogramme montre un ventricule gauche, des valves, des cavités droites et un péricarde normaux. Une épreuve d’effort couplée à une scintigraphie myocardique, réalisée deux mois avant, était maximale et négative. Un bilan biologique complet, comprenant notamment : NFS, CRP, ionogramme sanguin, TSH, D-Dimères, troponine, BNP, s’avère strictement normal. Le patient est mis sous apixaban 5 et bisoprolol 2,5. Un Holter sur 24 heures est réalisé au 4e jour de ce traitement et montre la persistance de l’arythmie en salves courtes quasi permanentes, plusieurs milliers par 24 heures (figure 2). Pendant les 2 à 3 jours avant que la cause ne fût découverte, le seul symptôme était un bref étourdissement en règle en parlant.
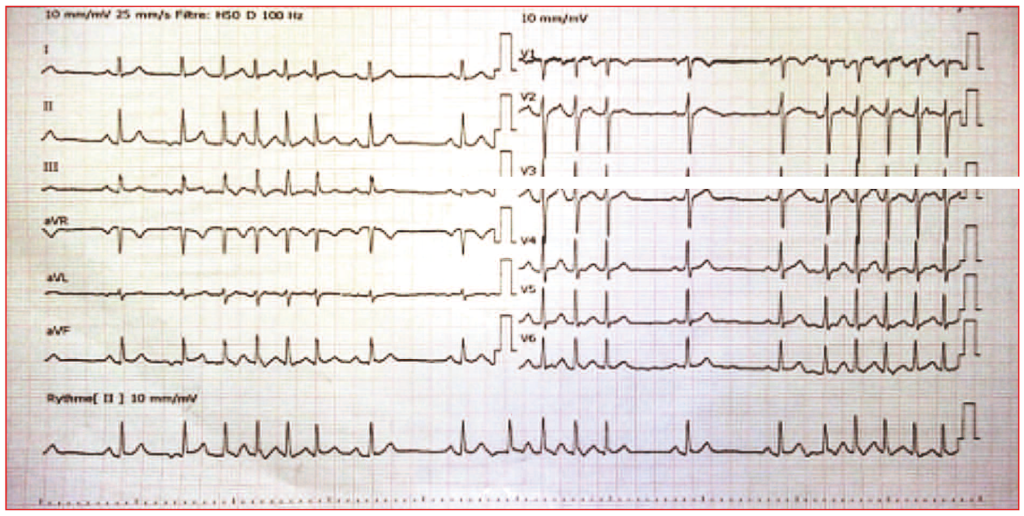
Figure 1. ECG avec salves de tachycardie atriale (TA) récidivantes.
Figure 2. Holter avec salves de TA incessantes sur les 24 heures.
Discussion
Une cause toxique a été rapidement évoquée devant cette excitabilité sur cœur apparemment sain, mais kaliémie et TSH notamment étaient, comme on l’a vu, normales. Le patient qui nous avait dit ne prendre aucun médicament nous précise au 3e jour que, depuis 8 mois, tous les soirs à 19 heures, il met une goutte de latanoprost dans l’œil gauche à la demande de son ophtalmologiste.
Ce traitement local a rapidement permis de baisser la pression oculaire de cet œil de 26 à 17.
Le lanatoprost est un analogue de la prostaglandine F2a. Sous forme de solution collyre délivrée en récipient unidose de 0,2 ml dosé à 50 μg/ml, il a pour effet d’augmenter l’écoulement de l’humeur aqueuse ce qui contribue à faire diminuer la pression dans l’œil qui doit rester inférieure à 20.
Pratiquement pas métabolisé dans l’oeil, son métabolisme est principalement hépatique. Sa demi-vie est de 17 heures. Ses métabolites ont une activité faible à nulle et sont principalement éliminés dans les urines. Sur la notice d’utilisation de ce collyre, il est précisé qu’après avoir déposé une goutte dans l’œil à traiter, il faut appuyer légèrement avec le doigt sur le coin interne de l’œil, proche du nez, pendant une minute tout en gardant l’œil fermé (figure 3).

Figure 3. Comment administrer le collyre. (A) Dépôt de la goutte. (B) Compression à l’angle interne de l’oeil.
Le patient avait vu ce détail, mais a dit qu’il ne le faisait pas, pensant que son oeil avait été assez bien instillé sans cette compression, et qu’il ne voulait pas prendre le risque d’irriter son œil avec le doigt. Cette compression digitale de l’angle de l’œil vise en fait à occlure l’orifice d’entrée du canal lacrymal et éviter ainsi les effets systémiques du produit du fait de l’absorption par la muqueuse. L’arrêt du collyre sera efficace dès la 12e heure avec de très rares extrasystoles puis la normalisation complète de l’ECG avant la 24e heure. Le bisoprolol est arrêté. Un Holter de contrôle, réalisé trois jours après l’arrêt du bêtabloqueur, est strictement normal.
Cet effet indésirable à type d’étourdissement ou de palpitation est apparemment connu et rare (1 patient sur 10 000). En pharmacovigilance, en France, 2 cas de tachycardie régressant à l’arrêt ont été signalés, et dans le monde, 11 cas de fibrillation atriale ont été rapportés, dont 3 pour lesquels l’évolution est connue et a été favorable à l’arrêt du traitement. Notre observation est particulièrement bien documentée objectivant des milliers de salves de tachycardie atriale, sur cœur apparemment sain, rapidement régressives à l’arrêt du collyre.

Perspectives thérapeutiques dans le syndrome cardio-rénal

Antoine FAYOL*/**, Étienne PUYMIRAT***, Marine LIVROZET*, Jean-Sébastie HULOT*,*Centre d’investigation clinique **Unité médico-chirurgicale d’insuffisance cardiaque sévère ***Unité de soins intensifs de cardiologie Hôpital européen Georges Pompidou, Paris
La prise en charge du syndrome cardio-rénal va probablement évoluer dans les années à venir grâce à l’arrivée d’un nouvel arsenal thérapeutique pour les patients insuffisants cardiaques. L’objectif de ce troisième article est de présenter ces nouvelles classes thérapeutiques qui arrivent progressivement sur le marché : les gliflozines, la finérénone, le vériciguat ou l’omecamtiv mecarbil. Ils ont très probablement une place à trouver dans la prise en charge des syndromes cardio-rénaux.
Une meilleure organisation
En 2019, l’AHA recommande la création d’unités spéciales pour la prise en charge des patients ayant un syndrome cardio-rénal via la création de structures regroupant cardiologues et néphrologues pour proposer une prise en charge commune au patient(1).
L’identification d’un diagnostic étiologique, tant cardiologique que néphrologique, semble indispensable pour la prise en charge des patients et pour l’optimisation des thérapeutiques. Le bilan d’insuffisance cardiaque et d’insuffisance rénale doit donc être fait en même temps.
La création d’une consultation spécialisée avec une surveillance régulière de la volémie du patient pourrait limiter les récidives de décompensations cardiaques.
Les caractéristiques cliniques des patients dans les essais thérapeutiques portant sur le syndrome cardio-rénal nous permettent d’envisager l’intérêt de l’évaluation de nouvelles classes thérapeutiques. Pour rappel, la majorité des patients présentant un syndrome cardio-rénal sont des hommes avec des comorbidités (hypertension, diabète dans 50 à 60 % des cas, fibrillation atriale) et une cardiopathie ischémique avec une altération de la FEVG dans 50 à 60 % des cas(2,3).
Les gliflozines
Le bénéfice cardiovasculaire des gliflozines a d’abord été confirmé chez les patients diabétiques. Le tableau 1 récapitule les principaux essais thérapeutiques.
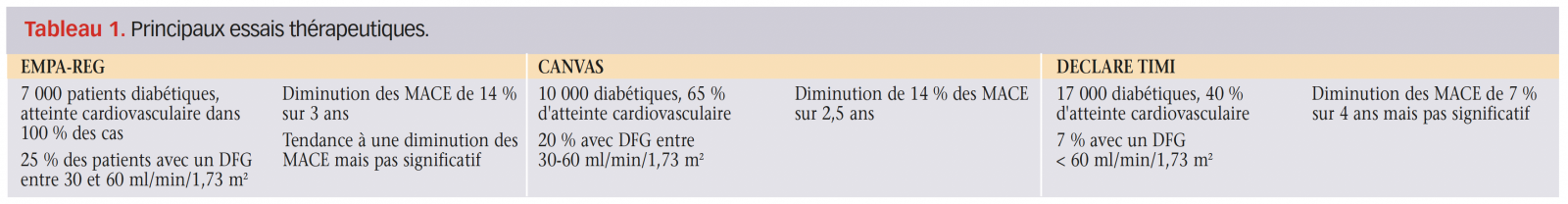
Une métaanalyse en 2019 (EMPA-REG, CANVAS, DECLARE TIMI(4-6)) s’est intéressée aux patients ayant un DFG entre 30 et 60 ml/min/1,73 m2. Pour ce groupe de patients, on observe une diminution du risque d’hospitalisation pour insuffisance cardiaque (HR 0,6), du nombre de MACE (HR 0,82) et des événements rénaux (HR 0,67).
Leurs bénéfices concernant l’insuffisance cardiaque sont également confirmés pour les patients ayant une HFrEF qu’ils soient diabétiques ou non(6,7). Dans une métaanalyse récente portant toujours sur les patients ayant une HFrEF, les patients ayant un DFG < 60 ml/min/1,73 m2 avaient une diminution significative des hospitalisations pour décompensation cardiaque et de la mortalité cardiovasculaire (HR 0,77).
Dans l’étude CREDENCE(8) (figure 1), les patients inclus étaient cette fois-ci diabétiques avec une albuminurie > 300 mg/g et un DFG entre 30 et 90 ml/ min (sous traitement conventionnel maximal). Le critère de jugement principal n’était plus cardiaque mais rénal : il s’agissait d’un critère composite d’apparition d’insuffisance rénale terminale (dialyse ou transplantation), d’un doublement de la créatinine basale ou de la mortalité cardiovasculaire et/ou rénale. L’étude a été interrompue précocement du fait d’une diminution des événements rénaux de 30 % (doublement de la créatinine ou mortalité rénale et cardiovasculaire).

Figure 1. Résultats de l’étude CREDENCE(8).
Dans l’étude DAPA-CKD (figure 2), les patients étaient diabétiques ou non avec un DFG entre 25 et 75 ml/min/1,73 m2 et une albuminurie comprise entre 0,2 g/g et 5 g/g. Le critère composite principalement rénal a lui aussi été rapidement validé (réduction de risque relatif de 37 %) avec de nouveau un arrêt précoce de l’étude(9).

Figure 2. Résultats de l’étude DAPA-CKD(9).
Enfin on peut également citer l’étude VERTIS qui s’est intéressée à l’ertugliflozine, et qui a montré qu’elle était non inférieure au placebo pour la prévention de la récidive d’événements cardiovasculaires majeurs(10).

La finérénone
La finérénone (antagoniste du récepteur aux minéralo-corticoïdes) a été évaluée chez les patients diabétiques, insuffisants rénaux dans l’étude FIDELIODKD(11) (figure 3). Au total, 5 734 patients avec un DFG compris entre 25 et 75 ml/min/1,73 m2 (avec une albuminurie > 30 mg/g) ont été inclus. Le critère de jugement principal était un critère composite associant la mortalité rénale, l’apparition d’une insuffisance rénale et une diminution de 40 % du eDFG.

Figure 3. Résultats de l’étude FIDELIO(11).
Après 2,6 ans de suivi, les patients traités par finérénone avaient une réduction significative du critère de jugement principal par rapport aux patients traités par placebo (HR 0,82 ; IC95% : 0,73-0,93 ; p = 0,001). Il y avait aussi une diminution significative du risque de survenue de MACE (AVC, infarctus du myocarde, décès d’origine cardiovasculaire) (HR 0,86 ; IC95% : 0,75- 0,99 ; p = 0,03).

Le vériciguat
Le vériciguat est un stimulateur de guanylate cyclase soluble oral, qui intervient via la voie de la guanosine monophosphate (GMP) cyclique. Il favorise la sensibilité de la guanylate cyclase soluble à l’oxyde nitrique (NO) endogène (stabilise la liaison) ce qui entraîne une vasorelaxation et une inhibition de la prolifération des muscles lisses(12).
Il a été evalué chez des patients avec une insuffisance cardiaque à FE réduite. Au total, 10 % d’entre eux avaient un DFG estimé à moins de 30 ml/min/m2 et 42 % entre 30 et 60 ml/min/m2. Le critère de jugement principal était composite associant la mortalité cardiovasculaire et la survenue d’une hospitalisation pour insuffisance cardiaque (figure 4).
Figure 4. Résultats du critère de jugement principal et dans les analyses de sous-groupe en fonction du DFG(13).
Le critère de jugement principal est survenu chez 35,5 % des patients traités et chez 38,5 % des patients ayant reçu le placebo (HR 0,90 ; IC95% : 0,82- 0,98 ; p = 0,02). Les analyses en sous-groupe n’étaient pas en faveur de l’utilisation du vériciguat chez les patients ayant un DFG < 30 ml/min/1,73 m2.

L’omecamtiv mecarbil
L’omecamtiv mecarbil(14) est un activateur direct de la myosine cardiaque, agissant directement au niveau du sarcomère, ce qui a comme effet d’augmenter le volume d’éjection systolique et de favoriser le remodelage du ventricule gauche.
Il a été évalué chez 8 256 patients avec une FEVG altérée (FEVG ≤ 35 %), ayant été hospitalisés pour un épisode de décompensation cardiaque dans l’année. Le DFG médian des patients inclus était de 58 ml/min/1,73 m2. Le critère de jugement principal était composite associant la mortalité d’origine cardiovasculaire et la survenue d’une hospitalisation pour insuffisance cardiaque.
Après 21,8 mois de suivi (figure 5), on observe une diminution significative du risque de survenue du critère composite chez les patients traités par omecamtiv mecarbil (1 523/4 120 patients [37,0 %] vs 1 607/4 112 patients [39,1 %] — HR 0,92 ; IC95% : 0,86-0,99 ; p = 0,03) ; sans diminution de la mortalité cardiovasculaire (HR 1,01 ; IC95% : 0,92- 1,11).
Figure 5. Résultats de l’étude et dans les sous-groupes d’intérêts GALACTIC-HF(14).
Les analyses en sous-groupes sont en faveur d’une efficacité plus importante du traitement chez les patients ayant une FEVG < 28 % (HR 0,84 ; IC95% : 0,77-0,92).

En pratique
▸ Une coopération entre cardiologues et néphrologues semble essentielle pour une prise en charge optimale des patients ayant un syndrome cardio-rénal. La création d’unités spéciales dédiées aux syndromes cardio-rénaux permettrait de faciliter la mise en place de thérapeutiques personnalisées.
▸ Les essais randomisés évaluant les nouvelles thérapeutiques disponibles sont nécessaires pour les patients ayant une insuffisance rénale chronique stade 4 et 5 et restent à prévoir.
Références
Cliquez sur les références et accédez aux Abstracts sur 
1. Janani R et al. Cardiorenal syndrome: classification, pathophysiology, diagnosis, and treatment strategies: a scientific statement from the American Heart Association. Circulation 2019 ; 139 : e840-e878. Rechercher l’abstract
2. Bart BA et al. Ultrafiltration in decompensated heart failure with cardiorenal syndrome. N Engl J Med 2012 ; 367 : 2296-304. Rechercher l’abstract
3. Costanzo MR et al. Ultrafiltration versus intravenous diuretics for patients hospitalized for acute decompensated heart failure. J Am Coll Cardiol 2007 ; 49 : 675-83. Rechercher l’abstract
4. Zinman B et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med 2015 ; 373 : 2117-28. Rechercher l’abstract
5. Lytvyn Y et al. Sodium glucose cotransporter-2 inhibition in heart failure. Circulation 2017 ; 136 : 1643-58. Rechercher l’abstract
6. Wiviott SD et al. Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2019 ; 380 : 347-57. Rechercher l’abstract
7. McMurray JJV et al. Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med 2019 ; 381 : 1995-2008. Rechercher l’abstract
8. Perkovic V et al. Canagliflozin and renal outcomes in type 2 diabetes and nephropathy. N Engl J Med 2019 ; 380 : 2295-306. Rechercher l’abstract
9. Heerspink HJL et al. Dapagliflozin in patients with chronic kidney disease. N Engl J Med 2020 ; 383 : 1436-46. Rechercher l’abstract
10. Cannon CP et al. Cardiovascular outcomes with ertugliflozin in type 2 diabetes. N Engl J Med 2020 ; 383 : 1425-35. Rechercher l’abstract
11. Bakris GL et al. Effect of finerenone on chronic kidney disease outcomes in type 2 diabetes. N Engl J Med 2020 ; 383 : 2219-29. Rechercher l’abstract
12. Stasch JP et al. Soluble guanylate cyclase as an emerging therapeutic target in cardiopulmonary disease. Circulation 2011 ; 123 : 2263-73. Rechercher l’abstract
13. Armstrong PW et al. Vericiguat in patients with heart failure and reduced ejection fraction. N Engl J Med 2020 ; 382 : 1883-93. Rechercher l’abstract
14. Teerlink JR et al. Cardiac myosin activation with omecamtiv mecarbil in systolic heart failure. N Engl J Med 2020 Nov 13. Rechercher l’abstract
Stimulation cardiaque : quelles nouveautés ?
Romain ESCHALIER, service de cardiologie, CHU de Clermont-Ferrand
Depuis les premières implantations de stimulateurs cardiaques externes puis endovasculaires dans les années 1950-1960, cette discipline a connu de nombreux progrès dans des domaines très variés : compréhensions physiopathologiques, technologiques, techniques d’implantation, algorithmiques. Cependant, certains de ces progrès sont maintenant anciens, et même si la sécurité de ces implantations est excellente, il reste des domaines dans lesquels nous nous devons d’être plus performants.
Nous sommes depuis quelques années dans une période de transition enthousiasmante. Nous vivons en effet une rupture technologique, mais aussi dans certains cas, des changements de paradigme. J’ai fait le choix arbitraire et forcément discutable de discuter la stimulation cardiaque sans sonde et de son évolution vers la synchronisation atrio-ventriculaire ; de la stimulation hissienne qui nous apporte une vision nouvelle et enfin des évolutions dans la stimulation biventriculaire. Les étapes futures consisteront probablement en une fusion/association de ces différentes techniques/approches.
La stimulation cardiaque sans sonde avec synchronisation atrio-ventriculaire
Les premières descriptions de stimulation cardiaque sans sonde datent de 1970(1), mais n’ont pas connu à cette époque-là d’essor du fait de difficultés technologiques.
Cependant le concept était né avec de nombreux avantages potentiels, comme l’absence de boîtier sous-cutané, de sonde intravasculaire ou intracardiaque, l’endothélialisation du système… Il a ensuite fallu attendre le début des années 2010 pour voir réapparaître cette technique via différentes techniques. Actuellement, seule l’implantation d’un stimulateur cardiaque sans sonde MICRA (Medtronic©, Minneapolis, MN, USA) est autorisée.
Les premiers stimulateurs cardiaques sans sonde Micra simple chambre ont été implantés en France dans le cadre d’un protocole de recherche à l’IHU de Bordeaux (Dr Ritter, Pr Bordachar) en 2014 puis en pratique courante à partir de 2015 (65 000 dans le monde). L’efficacité et la sécurité de cette technique(2,3) a conduit les autorités à permettre l’utilisation en pratique courante de la stimulation cardiaque sans sonde (Arrêté Journal officiel du 21 février 2019) selon des recommandations précises i) stimulation ventriculaire exclusive (i.e. certains BAV paroxystiques, BAV complet sur FA ou brady FA) ; et ii) chez des patients à haut risque de complications post-implantatoires avec un système traditionnel (i.e. dialyse chronique avec FAV, antécédent de sepsis ou endocardite).
Cependant, cette technique ne s’intéresse qu’à une portion limitée des patients implantés de stimulateurs cardiaques : ceux n’ayant pas besoin d’une synchronisation atrio-ventriculaire permanente.
Il était donc indispensable de pouvoir, via les améliorations technologiques et algorithmiques, permettre une synchronisation atrio-ventriculaire et ainsi élargir les options pour nos patients.
La détection de la systole atriale (onde A en échocardiographie) est basée sur le signal de l’accéléromètre intégré au dispositif. Cette détection atriale dynamique permet d’ajuster le timing de la stimulation ventriculaire afin d’obtenir une bonne synchronisation AV. Des filtres ont été conçus afin d’éviter la surdétection du bruit lié à l’activité mécanique cardiaque intrinsèque, mais aussi au remplissage passif. Lorsqu’une contraction atriale est détectée, un intervalle AV est débuté (mode VDD, 10 ms du fait du délai électro-mécanique) conduisant à une stimulation ventriculaire (figure). En l’absence de détection atriale, une stimulation ventriculaire droite est réalisée avec un intervalle plus long (environ 100 ms) que l’intervalle RR médian(4). Enfin, afin de limiter la stimulation VD, le dispositif vérifie périodiquement l’existence d’une conduction AV (mode VVI 40 + vérification de la conduction) et retour en VDD en cas de stimulation VD à 40 bpm (intérêt en cas de BAV paroxystiques). L’étude MARVEL 2 a démontré une nouvelle fois l’efficacité (95 % des patients avec une synchronisation AV > 70 % du temps en VDD vs 0 % en VVI, p < 0,001) et la sécurité (aucune pause ni aucun épisode de tachycardie induite par la stimulation) de cette technique(5). Les caractéristiques du MICRA AV (1,75 g, 0,8 cc, 18 mm, IRMcompatibilité) et la technique d’implantation sont similaires au MICRA VR avec une longévité estimée entre 8 et 13 ans (vs 12 ans pour le VR).


Figure. Synchronisation atrio-ventriculaire du MICRA AV.
AM : marqueur de l’activité mécanique atriale indiquant que le dispositif a détecté l’activité mécanique de l’oreillette (signal A4). VP : stimulation ventriculaire.
VE : marqueur de fin événements ventriculaires. Fenêtre de détection de A3 (phase passive de la diastole ventriculaire) : le réglage est peu sensible (ligne rouge) de façon à ce que seul un signal de forte amplitude puisse être détecté. Fenêtre de détection de A4 : utilisée pour détecter le signal A4 (systole atriale). Blanking atrial post-ventriculaire (PVAB) : aucune détection atriale n’a lieu pendant cette période.
En France, les premiers Micra AV ont été implantés en mai 2020 (plus d’une cinquantaine de patients).
La stimulation hissienne
La stimulation ventriculaire droite peut avoir des effets délétères sur la fonction ventriculaire gauche et ainsi induire une cardiopathie rythmique. Cette cardiopathie survient d’autant plus s’il existe une dysfonction ventriculaire gauche préalable même modérée. Ainsi, lorsque cela est possible (i.e. dysfonction sinusale ou BAV paroxystique) il est impératif d’utiliser les algorithmes de préservation de la conduction atrio-ventriculaire afin de réduire le pourcentage de stimulation ventriculaire droite.
Lorsque la stimulation ventriculaire est indispensable, l’objectif est donc de se rapprocher au maximum d’une activation ventriculaire physiologique homogène. C’est ainsi que depuis quelques années, la stimulation hissienne suscite un intérêt et un enthousiasme majeurs, plus particulièrement ces derniers mois dans l’alternative à la CRT classique.
L’implantation consiste à l’utilisation d’une sonde dédiée dans une gaine afin d’obtenir un enregistrement du faisceau de His. La stimulation hissienne peut être sélective ou non (fusion de la capture du his et des tissus ventriculaires adjacents). Le recueil ventriculaire est souvent plus faible que dans les autres sites ventriculaires droits avec des seuils plus élevés nécessitant une stimulation avec durée d’impulsion de 1 ms. Une capture d’un bloc de branche est également possible, mais nécessite une énergie supérieure.
Différentes populations ont été étudiées (BAV complet, BBG…) avec des résultats encourageants et positifs, y compris sur des critères durs. Cependant, ces études n’ont concerné majoritairement qu’un nombre limité de patients, et étaient régulièrement rétrospectives, monocentriques ou non randomisées. De nombreuses interrogations subsistent comme l’identification pré-implantation des patients pouvant le plus bénéficier de la stimulation hissienne ; différence entre stimulation sélective ou non ; anomalies de conduction distales…
La stimulation hissienne est une technique très prometteuse, mais des améliorations technologiques ainsi que des études randomisées, multicentriques de plus grande envergure chez les patients en BAV complet ou devant bénéficier d’une CRT vont/doivent être menées.
Resynchronisation cardiaque
La stimulation biventriculaire (CRT) est un outil mature de l’arsenal thérapeutique de l’insuffisance cardiaque à fraction d’éjection altérée avec asynchronisme électrique en association aux traitements médicamenteux. Les évidences sont claires sur son bénéfice concernant l’amélioration des symptômes, de la fonction systolique ventriculaire gauche ; mais aussi la réduction des hospitalisations pour IC et la mortalité. Le bénéfice le plus important de la CRT a été démontré chez les patients présentant un asynchronisme électrique important (i.e. BBG > 150 ms, zone latéro-basale d’activation retardée). Dans d’autres populations, comme les patients en fibrillation atriale, avec un bloc indifférencié, une cardiopathie ischémique le bénéfice peut être plus faible. C’est ainsi que l’on se souvient qu’environ 30 % des patients sont considérés comme « nonrépondeurs » à la CRT. Il est donc indispensable de mieux identifier ces patients, les raisons de la non-réponse et de trouver d’autres stratégies thérapeutiques pour améliorer cette dernière.
Les sondes quadripolaires implantées actuellement permettent la stimulation VG multipoint (MPP). Après de nombreuses études de faibles envergures, monocentriques montrant un bénéfice, le soufflé est retombé après les résultats de l’étude MORE-CRT MPP(6). Aucun bénéfice n’a été mis en évidence pour l’activation du MPP chez les non-répondeurs. Un sous-groupe avec un écart anatomique inter-électrode de plus de 30 mm et un délai court de stimulation de 5 ms semble avoir un bénéfice. Une étude est en cours en ce sens(7).
Une autre option pourrait être la stimulation multi-zone et endocardique via différents moyens technologiques. Différents systèmes sont en cours d’évaluation dont la mise en place de puces endocardiques à différents niveaux (VG principalement) avec un système de générateur sans fil implanté à proximité (UCLA and TIH, WISE-CRT). Ceci permettrait de rendre une stimulation VG plus homogène. Enfin, la stimulation hissienne (cf. supra) et la stimulation de la branche gauche semblent être des solutions encourageantes, mais qui nécessitent encore des investigations robustes.

Références
Cliquez sur les références et accédez aux Abstracts sur 
1. Spickler JW et al. Totally self-contained intracardiac pacemaker. J Electrocardiol 1970 ; 3 : 325-31. Rechercher l’abstract
2. Reynolds D et al. A leadless intracardiac transcatheter pacing system. N Engl J Med 2016 ; 374 : 533-41. Rechercher l’abstract
3. Duray GZ et al. Long-term performance of a transcatheter pacing system: 12-month results from the Micra transcatheter pacing study. Heart Rhythm 2017 ; 14 : 702-9. Rechercher l’abstract
4. Chinitz L et al. Accelerometer-based atrioventricular synchronous pacing with a ventricular leadless pacemaker: results from the Micra atrioventricular feasibility studies. Heart Rhythm 2018 ; 15 : 1363-71. Rechercher l’abstract
5. Steinwender C et al. Atrioventricular synchronous pacing using a leadless ventricular pacemaker: results from the MARVEL 2 study. JACC Clin Electrophysiol 2020 ; 6 : 94-106. Rechercher l’abstract
6. Leclercq C et al. Rationale and design of a randomized clinical trial to assess the safety and efficacy of multipoint pacing therapy: MOre REsponse on Cardiac Resynchronization Therapy with MultiPoint Pacing (MORE-CRT MPP-PHASE II). Am Heart J 2019 ; 2 Rechercher l’abstract
7. Leclercq C et al. Cardiac resynchronization therapy non-responder to responder conversion rate in the more response to cardiac resynchronization therapy with MultiPoint Pacing (MORE-CRT MPP) study: results from Phase I. Eur Heart J 2019 ; 40 : 2979- 87 Rechercher l’abstract
Interação entre telefones celulares e CDI
Arritmias ventriculares graves, que geralmente trazem risco de morte, são grande parte das vezes tratadas com cardioversores-desfibriladores implantáveis (CDI), que são compostos, de forma simplificada, por uma bateria, capacitores e um circuito de sensing/pacing. O sistema embutido no dispositivo responde a um campo magnético aplicado externamente e quando isso ocorre a terapia de choque fica suspensa temporariamente, ou seja, o aparelho não dará o choque se o paciente apresentar fibrilação ou taquicardia ventricular.
O novo aparelho iPhone 12, lançado recentemente, apresenta uma matriz circular de ímãs ao redor de uma bobina central, que faz com que seja compatível com acessórios MagSafe e possa ser realizado carregamento sem fio, de forma rápida, entre outras funções.

Interação entre as tecnologias
Recentemente houve relatos de possível interação do telefone com aparelhos de CDI que seria decorrente de um forte campo magnético gerado pelo Iphone e tecnologia MagSafe. Isso foi confirmado em experimento em que o telefone foi aproximado da região torácica esquerda de paciente com CDI e houve suspensão imediata das terapias do aparelho, que persistiu durante todo o teste. Esse experimento foi reproduzido diversas vezes com o telefone em diferentes posições, com o mesmo efeito. Aparelhos mais antigos não tem essa capacidade.
Também foi feito experimento randomizado de forma cega, com crossover que comparou o iPhone 12 com o iPhone XS (que não contém a tecnologia MagSafe). Os telefones eram colocados em envelopes, aproximados a menos de 2 cm do CDI por pelo menos 30 segundos e era feita avaliação do CDI. Não houve interação do iPhone XS com o CDI, porém o iPhone 12 causou suspensão da detecção de arritmias e inibição da terapia em dispositivos de diferentes marcas. Além disso, fez com houvesse reprogramação do marca-passo para modo assíncrono em um aparelho de marca específica.
Conclusão
As consequências da interação de telefones com essa nova tecnologia e aparelhos de CDI podem ser catastróficas. Como maneira de prevenir que isso ocorra, devemos reforçar ainda mais aos pacientes que usam esses dispositivos que não devem colocar os telefones próximos ao CDI, assim como qualquer outro dispositivo eletrônico que possa ter potencial de causar alterações semelhantes.
Autor(a):
Isabela Abud
Editora de cardiologia do Portal PEBMED ⦁ Graduação em Medicina pela Escola Paulista de Medicina da Universidade Federal de São Paulo (UNIFESP) ⦁ Residência em Clínica Médica pela UNIFESP ⦁ Residência em Cardiologia pelo Instituto do Coração (InCor) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (USP) ⦁ Atualmente atuando nas áreas de terapia intensiva, cardiologia ambulatorial, enfermaria e em ensino médico.
Referências bibliográficas:
- Greenberg JC, et al. Letter to the Editor—Lifesaving Therapy Inhibition by Phones Containing Magnets. 2021 Jan 5;S1547-5271(20)31227-3. doi: 1016/j.hrthm.2020.12.032.
- Patterson Z, et al. Letter to the Editor: New phones, old problem? Interference with cardiovascular implantable electronic devices by phones containing magnets. Heart Rhythm. 2021 Feb 2;S1547-5271(21)00105-3. doi: 1016/j.hrthm.2021.01.029.
SOLOIST-WHF démontre les bénéfices de la sotagliflozine dans l’insuffisance cardiaque aiguë du patient diabétique

Patrice DARMON, Marseille
Les inhibiteurs des co-transporteurs du sodium-glucose de type 2 (iSGLT2) ont largement démontré leurs bénéfices dans la prévention des hospitalisations pour insuffisance cardiaque chez les patients diabétiques de type 2 (DT2) à haut et très haut risque cardiovasculaire et dans le traitement de l’insuffisance cardiaque à fraction d’éjection du ventricule gauche (FEVG) diminuée en présence comme en l’absence de diabète.
La sotagliflozine est un iSGLT2 inhibant également les co-transporteurs du sodium-glucose de type 1 (iSGLT1) au niveau intestinal ; à ce jour, ce double inhibiteur SGLT1/2 n’est autorisé qu’en Europe, comme traitement adjuvant du diabète de type 1 chez les patients en surpoids (IMC ≥ 27 kg/m2). L’objectif de l’étude SOLOIST-WHF était d’évaluer les bénéfices et les risques de la sotagliflozine dans le contexte particulier de l’insuffisance cardiaque aiguë chez des patients DT2. L’essai a dû être stoppé prématurément en raison du désengagement financier du sponsor durant la pandémie de la Covid-19, mais des résultats très positifs ont été présentés au cours du dernier congrès virtuel de l’American Heart Association et publiés simultanément dans le New England of Medicine.
L’étude a inclus 1 222 patients DT2 âgés de moins de 85 ans hospitalisés pour décompensation d’une insuffisance cardiaque avec nécessité d’un recours à des diurétiques en intraveineux et élévation significative des taux de peptides natriurétiques. Les critères d’exclusion étaient les suivants : insuffisance cardiaque terminale ; syndrome coronarien aigu, revascularisation coronarienne ou accident vasculaire cérébral récents ; DFGe < 30 ml/min/1,73 m2 ; instabilité clinique (définie par le besoin de recourir à une oxygénothérapie ou à un traitement inotrope ou vasodilatateur en intraveineux — à l’exception des dérivés nitrés — ou de poursuivre les diurétiques en intraveineux ou par une pression artérielle systolique < 100 mmHg). Les sujets ont été randomisés pour recevoir de la sotagliflozine (200 mg/j, pouvant être augmentée à 400 mg/j en l’absence d’effets secondaires) ou un placebo, soit avant la sortie (48,8 % des cas), soit dans les trois jours suivant la sortie (51,2 %). Les caractéristiques des patients à l’inclusion étaient les suivantes : âge médian 70 ans ; 33,7 % de femmes ; IMC 30,8 kg/m2 ; FEVG 35 % (< 50 % dans 79,1 % des cas) ; NT-proBNP 1799,7 pg/ml ; DFGe 49,7 ml/min/1,73 m2 ; HbA1c 7,1 %. Le critère primaire de jugement, modifié à l’arrêt des inclusions pour augmenter la puissance de l’étude, était un critère composite des décès d’origine cardiovasculaire et du nombre total d’hospitalisations et de visites en urgence pour insuffisance cardiaque. Au terme d’un suivi médian de seulement 9 mois, ce critère était réduit de façon significative sous sotagliflozine (51,0 vs 76,3 événements pour 100 patients-années ; HR 0,67 [IC95% 0,52-0,85], p < 0,001). Ce bénéfice était retrouvé à l’identique dans tous les sous-groupes étudiés (hommes ou femmes, âge < ou ≥ 65 ans, origine géographique des centres, traitement débuté avant ou après la sortie, FEVG < ou ≥ 50 %, DFGe < ou ≥ 60 m/min/1,73 m2). Le bénéfice de la sotagliflozine est également retrouvé sur le critère de jugement initialement prévu (décès cardiovasculaire ou première hospitalisation pour insuffisance cardiaque) avec un HR à 0,71 (IC95% 0,56-0,89). À l’inverse, la réduction observée du risque de décès d’origine cardiovasculaire et de décès de toutes origines n’était pas significative (HR 0,84 [IC95% 0,58-1,22] et HR 0,82 [IC95% 0,59-1,14], respectivement).
Les données sur la sécurité de la sotagliflozine, et plus particulièrement sur les événements liés à la déplétion volémique, étaient très attendus dans ce contexte d’insuffisance cardiaque aiguë, et elles sont rassurantes : pas de différence significative entre sotagliflozine et placebo pour les épisodes d’hypotension (6,0 % vs 4,6 %) et d’insuffisance rénale aiguë (4,1 % vs 4,4 %). Les seuls effets indésirables retrouvés plus souvent sous sotagliflozine étaient les diarrhées (6,1 % vs 3,4 %), les hypoglycémies sévères (1,5 % vs 0,3 %) et les infections génitales (0,8 vs 0,2 %) ; les épisodes d’acidocétose étaient rares et moins fréquents sous sotagliflozine que sous placebo (0,3 % vs 0,7 %).
Au final, en dépit de son interruption prématurée, cet essai démontre que la sotagliflozine a un rapport bénéfices-risques hautement favorable en cas d’insuffisance cardiaque aiguë chez le patient diabétique de type 2, et ce, quelle que soit la FEVG. Il s’agit là d’une nouvelle preuve des bénéfices de l’inhibition de SGLT2 en cas d’insuffisance cardiaque, ici dans la situation très particulière de la période post-décompensation. Il reste à déterminer si l’inhibition de SGLT1 induite par la sotagliflozine apporte un bénéfice spécifique chez ces patients.
Publié par Diabétologie Pratique
Références
Cliquez sur les références et accédez aux Abstracts sur 
Bhatt DL et al., for the SOLOIST-WHF Investigators. Sotagliflozin in patients with diabetes and recent worsening heart failure. N Engl J Med 2020 Nov 16. Rechercher l’abstract
Ablation de la FA : le froid ou le chaud ?

Frédéric TRÉGUER, Albin BEHAGHEL, Clinique Saint-Joseph, Angers
Sur le plan technique, l’isolation des veines pulmonaires reste la pierre angulaire de la procédure d’ablation de la fibrillation atriale (FA) qu’elle soit paroxystique ou persistante. Il s’agit d’une approche centrée sur l’ablation du « trigger » c’est-à-dire sur les gâchettes électriques initiatrices de la FA. Les deux principaux écueils de cette technique sont l’importance des reconnexions de ces veines pulmonaires et l’existence de foyers initiateurs extraveineux pulmonaires. Pour isoler les veines pulmonaires, les deux techniques les plus couramment utilisées sont l’ablation par cryothérapie (CA) « le froid » et l’ablation par radiofréquence (RF) « le chaud » (figure 1).

Figure 1. Schéma illustrant l’isolation des veines pulmonaires par radiofréquence point par point (A) et à l’aide d’un ballon de cryothérapie (B). D’après Calkins et al.(2)
Ablation de la FA paroxystique
L’étude FIRE and ICE(1), menée chez des patients en FA paroxystique, est le premier essai prospectif contrôlé et randomisé à évaluer l’isolation des veines pulmonaires par ces deux techniques. Les résultats montrent la non-infériorité de la cryothérapie par rapport à la radiofréquence sur la survenue du critère primaire d’efficacité (absence de récidive de FA, flutter atrial, tachycardie atriale, reprise d’un traitement antiarythmique, nouvelle ablation) et sur la survenue du critère de sécurité. Plus récemment l’étude CIRCA-DOSE (patients avec une FA paroxystique dans 90 %) n’a pas retrouvé de différence sur le maintien en rythme sinusal à 1 an entre les deux techniques. Dans la FA paroxystique, l’ablation par l’une ou l’autre de ces deux énergies ne fait donc actuellement plus débat et dépend principalement des habitudes de chaque centre et de la disponibilité de la technique.
Ablation de la FA persistante
Mécanismes de la FA persistante et techniques d’ablation
La FA persistante peut survenir soit après un passé plus ou moins long de FA paroxystique, soit d’emblée de façon prolongée. Dans les deux cas, la persistance de la FA suppose qu’il existe en plus des activités électriques gâchettes, des mécanismes de perpétuation représentant le substrat de la FA.
Plusieurs hypothèses existent concernant les mécanismes de ce substrat, mais restent encore controversées : la théorie des vaguelettes, la théorie des rotors, la fibrose, l’influence du système nerveux autonome. De ces différents mécanismes découlent plusieurs cibles potentielles pour l’ablation : l’ablation des potentiels fragmentés, des rotors, des zones de bas voltage (fibrose), des ganglions, et la segmentation de l’oreillette gauche. Plusieurs études ont montré l’intérêt de réaliser une ablation du substrat dans l’ablation de la FA persistante(3). Ces techniques étant jusqu’à présent uniquement réalisées à l’aide d’un cathéter de radiofréquence, les ablations incluant le traitement du substrat sont donc restées pendant longtemps le domaine réservé de la radiofréquence.
La révolution STAR AF II(4)
Cette étude publiée dans le NEJM en 2015 avait pour but de comparer trois stratégies ablatives dans la FA persistante : i) isolation antrale des veines pulmonaires (IVP) ; ii) IVP + lignes d’ablation ; iii) IVP + ablation des potentiels fragmentés. La randomisation faite en 1 : 4 : 4 a inclus 589 patients. Contre toute attente, cette étude n’a pas montré de différences significatives entre les 3 groupes en termes de récidive de FA ou d’autres arythmies atriales à 18 mois de suivi (p = 0,15) (figure 2).

Figure 2. Étude STAR AF II : les taux de récidive de FA ne diffèrent pas significativement entre les 3 stratégies d’ablation. D’après Verma et al.(4)
Recommandations sur l’ablation de la FA persistante
Le dernier consensus d’experts des sociétés savantes européennes et américaines de 2017(2) précise que dans l’ablation de la FA persistante :
• L’isolation des veines pulmonaires par RF ou CA doit être réalisée (niveau de recommandation I).
• En cas d’antécédent de flutter commun ou si celui-ci est induit pendant la procédure, l’ablation de l’isthme cavotricuspidien doit être réalisée (niveau de recommandation I).
• L’intérêt de réaliser une ablation des potentiels fragmentés, des rotors, des ganglions et des lignes n’est pas clairement défini (niveau de recommandation IIb).
• Une isolation du mur postérieur peut être considérée (niveau de recommandation IIb).
À la lumière de ces recommandations, il est donc tout à fait possible de réaliser une ablation de FA persistante par RF ou par CA puisque seule l’isolation des veines est clairement validée.
Les études
Aucune étude randomisée n’a à ce jour comparé les deux techniques RF et CA dans la FA persistante. Cependant les premières études sur la cryothérapie semblent concluantes. L’étude Cryo4Persistante AF(5) a montré 61 % de succès (absence de récidive de FA) à 12 mois après une seule procédure de CA pour des FA persistantes. L’étude STOP Persistent AF6 a montré l’absence de récidive de FA à 12 mois chez 54,8 % (IC95% : 46,7 %-62,1 %) des patients ayant une FA de moins de 6 mois et traités par CA. À titre de comparaison les résultats d’une étude bordelaise(7) qui concernait des patients en FA persistante traités par RF montraient un taux de succès à 12 mois de 35,3 % ± 3,9 % après une seule procédure. Les patients de ces études avaient cependant un profil plus favorable avec des FA plus récentes, des OG peu dilatées et des scores de CHA2DS2VASc bas. Une autre étude récente(8) comparant chez des patients en FA persistante, une ablation par CA (isolation des veines pulmonaires seule) et une ablation par RF (isolation des veines pulmonaires et isolation du mur postérieur), n’a pas retrouvé de différence significative sur le pourcentage de patients en rythme sinusal à 19 ± 10 mois après plusieurs procédures (61 vs 68 %, p = 0,39, 167 patients inclus).
Limites de la cryothérapie dans l’ablation de la FA persistante
Sa principale limite, exposée dans les trois exemples ci-dessous, vient de la forme du cathéter qui n’est pas adaptable à des cibles focales ou à la réalisation de lignes d’ablation.
– comme mentionné en introduction, les triggers ou gâchettes initiatrices de la FA ont parfois une localisation extraveineuse. L’ablation de ces cibles focales nécessite le plus souvent l’emploi d’un cathéter de radiofréquence ;
– la transformation per-procédure de la FA en une tachycardie atriale focale ou par macroréentrée est fréquemment observée au cours des ablations de FA persistante. Leur ablation nécessite de réaliser des tirs focaux ou des lignes d’ablation, ce qui est difficilement envisageable de façon précise avec un ballon de cryothérapie ;
– enfin, l’ablation de l’isthme cavotricuspidien nécessite également l’utilisation d’un cathéter de radiofréquence.
Limites de la RF dans l’ablation de la FA persistante
La principale limite de la RF vient de la tentation de l’opérateur de réaliser une ablation plus extensive incluant le substrat avec comme principaux inconvénients :
– un effet proarythmique avec un risque accru de tachycardies atriales cicatricielles ;
– ces procédures plus complètes sont logiquement plus longues et le taux de complication augmente avec la durée de la procédure : risque embolique, perforations, risques liés à l’exposition aux rayons X ;
– enfin, l’isolation de l’auricule gauche est une conséquence possible d’une ablation trop extensive de l’oreillette gauche et expose à un risque embolique accru(9).
Ablation de la FA persistante avec ou sans système de cartographie tridimensionnel ?
Une des raisons permettant d’expliquer les taux de succès insuffisants obtenus après ablation de FA persistante est que l’intervention est réalisée trop tardivement, à un stade où le degré de fibrose atriale est trop avancé. La possibilité de réaliser des cartes de voltage au cours des procédures d’ablation de FA persistante offre des informations essentielles en termes pronostiques en estimant l’importance de ces zones cicatricielles. Une telle information va permettre de réaliser une ablation « à la carte » de la FA en ciblant des zones dites cicatricielles, ou éventuellement faire renoncer à une ablation rédux si le taux de succès estimé semble trop faible. Comme mentionné ci-dessus, il est courant d’obtenir au cours d’une procédure d’ablation une transformation de la FA en une tachycardie atriale dont la localisation nécessite l’utilisation d’un système de cartographie. Or pour des raisons pratiques et économiques, l’utilisation d’un système de cartographie au cours d’une ablation en cryothérapie est difficilement envisageable en routine. Indépendamment de la technique elle-même, l’intérêt de la RF réside donc aussi dans le système de cartographie qui lui est associé.
En pratique
▸ Dans l’ablation de la FA paroxystique, la radiofréquence et la cryothérapie font jeu égal en termes d’efficacité et de sécurité pour isoler les veines pulmonaires.
▸ Dans l’ablation de la FA persistante, aucune étude n’ayant montré l’intérêt de réaliser des lésions supplémentaires, il n’y a actuellement pas d’argument permettant de privilégier l’une ou l’autre de ces techniques.
▸ Cependant, les taux de succès insuffisants obtenus incitent à penser qu’il est nécessaire de réaliser des ablations également ciblées sur le substrat ou sur des foyers extra-veineux, ce qui n’est actuellement possible qu’en radiofréquence. De plus la localisation des tachycardies atriales induites et le complément d’ablation nécessaire à leur régularisation nécessitent un système de cartographie tridimensionnel et l’usage de la radiofréquence.
▸ Ainsi, en dehors des formes récentes (< 1 an) de FA persistante sur « oreillette saine », nous proposons dans notre centre une ablation par radiofréquence pour toutes les autres formes de FA persistante.
Références
Cliquez sur les références et accédez aux Abstracts sur 
1. Kuck KH et al. N Engl J Med 2016 ; 374(23) : 2235-45. Rechercher l’abstract
2. Calkins H et al. Europace 2018 ; 20(1) : 157-208. Rechercher l’abstract
3. Maurer T et al. J Intern Med 2016 ; 279(5) : 439-48. Rechercher l’abstract
4. Verma A et al. N Engl J Med 2015 ; 372(19) : 1812-22. Rechercher l’abstract
5. Boveda et al. JACC Clin Electrophysiol 2018 ; 4(11) : 1440-7. Rechercher l’abstract
6. Su WW et al. Heart Rhythm 2020 ; 17(11) : 1841-7. Rechercher l’abstract
7. Scherr D et al. Circ Arrhythm Electrophysiol 2015 ; 8(1) : 18-24. Rechercher l’abstract
8. Yokokawa M et al. Heart Rhythm 2018 ; 15(12) : 1835-41. Rechercher l’abstract
9. Di Biase et al. JACC 2019 ; 74(8) : 1019-28. Rechercher l’abstract
Prise en charge de la FA : contrôle du rythme ou de la fréquence ventriculaire ?

Sana AMRAOUI, Neuilly-sur-Seine
La fibrillation atriale (FA) est associée à un sur-risque d’événements thromboemboliques, mais aussi de morbi-mortalité. Au-delà du rôle essentiel du traitement anticoagulant dans la prévention du risque thromboembolique, face à un patient qui présente une FA, le cardiologue doit se poser la question fondamentale suivante : quand contrôler le rythme et quand contrôler la fréquence ventriculaire (V) ?
En effet, le choix entre les deux stratégies peut constituer un dilemme. Des données issues d’études publiées dans les années 2000 comparant le traitement anti-arythmique (AAR) au contrôle pharmacologique de la fréquence V ont créé une certaine confusion dans le choix de la meilleure stratégie à adopter en fonction du patient. Les dernières recommandations sur le diagnostic et la prise en charge de la FA parues en 2020 permettent de statuer sur certains points spécifiques comme la place des différentes stratégies thérapeutiques et notamment celle de l’ablation par cathéter(1).
Intérêt d’une prise en charge précoce
Prévention du risque thromboembolique
Entre 20 et 30 % des accidents vasculaires cérébraux (AVC) ischémiques est une conséquence de la FA, et c’est le cas pour 10 % des AVC cryptogéniques(2-4).
Substrat et remodelage myocardique
– Remodelage atrial électrique et mécanique : la transition d’une forme paroxystique à une forme plus évoluée est caractérisée par un remodelage structurel plus marqué du substrat atrial(5-7) ayant pour conséquence une progression vers une forme persistante dans l’année de 1 à 15 %(8,9). En effet, le substrat atrial (souvent corrélé au degré de dilatation des atria et de la dispersion de la fibrose dans celles-ci) entraîne une prolongation des temps de conduction électrique une perturbation du couplage électromécanique du tissu, et au final, un remodelage à l’origine de cette dysfonction atriale(10). Cette progression vers des formes persistantes/permanentes est associée à une majoration des complications cardio-vasculaires, des hospitalisations et de la mortalité(11).
– Dysfonction ventriculaire gauche et insuffisance cardiaque : entre 20 et 30 % des patients en FA présente une dysfonction ventriculaire gauche/insuffisance cardiaque, conséquence notamment d’une accélération de la cadence ventriculaire(12-14).
Qualité de vie et morbi-mortalité
Qualité de vie : la FA, par toutes ses conséquences, impacte fortement la qualité de vie, d’autant plus lorsque la charge en arythmie est élevée. Plus de 60 % des patients en FA décrivent une réduction significative de la qualité de vie(15-17).
Hospitalisation : approximativement 30 % des patients en FA ont été hospitalisés. Environ 10 % des patients en FA sont hospitalisés au moins 2 fois par an(18-20).
Mortalité : le diagnostic de FA est indépendamment associé à un risque de mortalité deux fois plus important chez les femmes et 1,5 fois plus élevé chez les hommes(21-23) avec un risque global supérieur de 3,5 fois notamment en raison de l’insuffisance cardiaque associée(24,25).

Impact clinique de la stratégie de contrôle de la fréquence cardiaque
Le contrôle des symptômes
Dans les années 2000, certaines études (RACE et AFFIRM) ont apporté des arguments en faveur de la stratégie de contrôle de la fréquence cardiaque, comparant le traitement médicamenteux AAR au contrôle de la fréquence V dans la prise en charge de la FA(26-28). Il avait été conclu que, comparée à la stratégie de contrôle de la fréquence V, la stratégie de contrôle du rythme n’apportait pas de bénéfice et pouvait même être associée à un risque de surmortalité. Pourtant, une étude post-hoc d’AFFIRM mettait en évidence que le maintien du rythme sinusal était un facteur de réduction de la mortalité, mais que l’usage des (AAR) était par contre, associé à une surmortalité, annulant ainsi le bénéfice potentiel d’une stratégie de contrôle du rythme(29).
Impact clinique de la stratégie de contrôle du rythme cardiaque
Elle consiste à maintenir et/ou à restaurer le rythme sinusal par cardioversion, traitement AAR et/ou ablation par cathéter, ainsi que le traitement des facteurs favorisant la FA. Les objectifs principaux de cette stratégie sont : 1- améliorer la qualité de vie par la réduction des symptômes ; 2- limiter la progression des formes paroxystiques vers des formes persistantes ou permanentes ; 3- et ainsi ralentir le développement de l’insuffisance cardiaque à composante rythmique(30).
Comparaison avec la stratégie de contrôle de la fréquence ventriculaire
Afin de lutter contre ces conséquences néfastes de la FA, même si intuitivement la stratégie de contrôle du rythme cardiaque pourrait sembler plus efficace qu’une stratégie de contrôle de la fréquence V, ce n’est que récemment que de nouvelles études ont confirmé cette hypothèse. En effet, jusqu’à présent, il n’y avait pas d’évidence absolue de cette théorie(26,31,33), ces études n’incluant pas l’ablation de FA par cathéter dans la stratégie de contrôle du rythme, technique qui a notamment démontré son efficacité dans l’étude CABANA(34,35), et dont le succès est synergique avec l’utilisation de traitements AAR(36,37).
Ralentissement de la progression vers les formes persistante et permanente de FA
Il a été démontré un ralentissement de la progression vers les formes persistantes/permanentes de FA lors de la stratégie de contrôle du rythme, comparativement à celle de contrôle de la fréquence cardiaque(38-40). Afin de répondre à cette question comparative et essentielle sur la stratégie précoce de contrôle du rythme, l’étude internationale randomisée et contrôlée parue en octobre 2020(41), a comparé ces deux stratégies notamment chez les patients avec FA diagnostiquée récemment (1 an avant inclusion). Le contrôle précoce du rythme cardiaque consistait à l’ablation de FA par cathéter et/ou la mise en place de traitement anti-arythmique. Sur un total de 135 centres et de 2 789 patients avec FA de moins d’un an inclus, l’étude a dû être stoppée après une médiane de plus de 5 ans par patient devant une réduction du critère combiné incluant la mortalité dans le bras de contrôle du rythme (comparativement à celui de contrôle de la fréquence V). En effet, la prise en charge précoce du patient avec contrôle du rythme cardiaque est associée à un risque global moins important de complications cardio-vasculaires (mortalité cardio-vasculaire, AVC, aggravation de l’insuffisance cardiaque) comparativement à la stratégie de contrôle de la fréquence V(42).
Évolutions dans les indications d’ablation de FA
L’ablation par cathéter de FA en première ligne thérapeutique
Cette technique peut être envisagée avant même l’utilisation de traitements AAR dans certains cas.
Cardiomyopathie rythmique : elle est recommandée avec indication de classe I (contre IIa en 2016) pour favoriser le remodelage inverse du VG chez les patients avec probabilité élevée de cardiomyopathie rythmique lors du passage en FA.
Absence de facteurs de risque de récidive de FA post-ablation : l’isolation des veines pulmonaires devrait être envisagée en première intention chez les patients avec FA symptomatique et les caractéristiques suivantes : épisodes de FA paroxystique (indication de classe IIa), ou épisodes de FA persistantes sans facteur de risque majeur de récurrence de FA, comme alternative aux traitements AAR de classe I ou III, en considérant les choix du patient, les bénéfices et les risques de la procédure (IIb).
L’ablation de FA après échec d’un traitement médicamenteux
L’isolation complète des veines pulmonaires est maintenant fortement recommandée avec indication de classe I (contre IIa en 2016) pour le contrôle du rythme cardiaque après échec ou intolérance à un traitement AAR de classe I ou III, chez les patients aux antécédents de : 1- FA paroxystique ; 2- FA persistante sans facteur de risque majeur de récidive de FA (hypertension artérielle, obésité, taille de l’OG, syndrome d’apnées du sommeil…) ; et même 3- FA persistante avec facteur de risque majeur de récidive de FA.
Les études des années 2000 avaient conclu que, comparativement à la stratégie de contrôle de la fréquence V, la stratégie de contrôle du rythme n’apportait pas de bénéfice. Cependant, ces études contrôlaient le rythme avec des traitements AAR associés à une surmortalité prouvée et n’utilisaient pas l’ablation par cathéter.
L’ablation par cathéter, initialement proposée en cas d’échec des AAR, a prouvé qu’elle était plus efficace que les traitements médicamenteux, notamment dans les formes précoces de FA permettant non seulement le contrôle des symptômes, mais aussi le ralentissement du passage de la forme paroxystique vers les formes persistantes puis permanentes. De plus, l’expérience grandissante des équipes de rythmologie interventionnelle a permis de réduire l’incidence globale des complications.
Les données récentes de réduction de la morbi-mortalité chez des patients où le choix a été fait de contrôler le rythme cardiaque tendent à nous faire privilégier cette stratégie, sauf dans les cas où l’efficacité escomptée est faible (que ce soit par le traitement anti-arythmique et/ou par l’ablation) et qu’elle ne contrebalance pas les risques liés à l’intervention. L’époque du choix systématique de la stratégie de contrôle de la cadence ventriculaire semble donc révolue.
Publié dans RythmologieS
Références
Cliquez sur les références et accédez aux Abstracts sur 
1. Pachulski Hindricks G et al.Eur Heart J 2020. Rechercher l’abstract
2. Pistoia F et al. Cardiol Clin 2016 ; 34(2) : 255-68. Rechercher l’abstract
3. Chao T-F et al. J Am Coll Cardiol 2015 ; 65(7) : 635 42. Rechercher l’abstract
4. Benjamin EJ et al. Circulation 2019 ; 139(10) : e56 528. Rechercher l’abstract
5. Goette A et al. Europace 2016 ; 18(10) : 1455 90. Rechercher l’abstract
6. Nattel S.Cardiovasc Res [Internet] 2016 [cité 31 oct 2020] ; 110(3) : 295 7. Disponible sur : https://www.ncbi.nlm.nih.gov/ pmc/articles/PMC4872882/ 7. Nattel S et al. Eur Heart J 2014 ; 35(22) : 1448 56. Rechercher l’abstract
7. Nattel S et al. Eur Heart J 2014 ; 35(22) : 1448 56. Rechercher l’abstract
8. Potpara TS et al. Chest 2012 ; 141(2) : 339 47. Rechercher l’abstract
9. Padfield GJ et al. Heart Rhythm 2017 ; 14(6) : 801 7. Rechercher l’abstract
10. Marrouche NF et al. JAMA 2014 ; 311(5) : 498 506. Rechercher l’abstract
11. Piccini JP et al. Europace 2019 ; 21(3) : 404 13. Rechercher l’abstract
12. Kotecha D et al. J Am Coll Cardiol 2016 ; 68(20) : 2217 28. Rechercher l’abstract
13. Wijesurendra RS et al. Cardiovasc Res 2015 ; 105(3) : 238 47. Rechercher l’abstract
14. Ziff OJ et al. Int J Cardiol 2018 ; 252 : 117 21. Rechercher l’abstract
15. Son Y-J et al. Int J Environ Res Public Health [Internet] 2019 [cité 31 oct 2020];16(17). Disponible sur : https://www.ncbi.nlm.nih. gov/pmc/articles/PMC6747178/ Rechercher l’abstract
16. Randolph TC et al. Am Heart J [Internet]. déc 2016 [cité 31 oct 2020] ; 182 : 135 43. Disponible sur : https://www.ncbi.nlm.nih .gov/pmc/articles/PMC5584577/ Rechercher l’abstract
17. Blum S et al. J Am Heart Assoc [Internet] 2017 [cité 31 oct 2020] ; 6(7). Disponible sur : https://www.ncbi.nlm.nih.gov/pmc/ articles/PMC5586278/ Rechercher l’abstract
18. Frost L et al. Arch Intern Med 2001 ; 161(2) : 272 6. Rechercher l’abstract
19. Meyre P et al. Risk of hospital admissions in patients with atrial fibrillation: a systematic review and meta-analysis. Can J Cardiol 2019 ; 35(10) : 1332 43. Rechercher l’abstract
20. Steinberg BA et al. Am Heart J [Internet] 2014 [cité 31 oct 2020];167(5):735-742.e2. Disponible sur : https://www.ncbi.nlm.nih. gov/pmc/ articles/PMC4006943/ Rechercher l’abstract
21. Andersson T et al. Eur Heart J 2013 ; 34(14) : 1061 7. Rechercher l’abstract
22. Benjamin EJ et al. Circulation 1998 ; 98(10) : 946 52. Rechercher l’abstract
23. Ugowe FE, Jackson LR. Eur Heart J Qual Care Clin Outcomes 2019 ; 5(1) : 6 7. Rechercher l’abstract
24. Magnussen C et al. Circulation 2017 ; 136(17) : 1588 97. Rechercher l’abstract
25. An Y et al. Eur Heart J Qual Care Clin Outcomes 2019 ; 5(1) : 35 42. Rechercher l’abstract
26. Van Gelder IC et al. N Engl J Med 2002 ; 347(23) : 1834 40. Rechercher l’abstract
27. Groenveld HF et al. Am Coll Cardiol 2011 ; 58(17) : 1795 803. Rechercher l’abstract
28. Al-Khatib SM et al. Ann Intern Med 2014 ; 160(11) : 760 73. Rechercher l’abstract
29. Van Gelder IC et al. Europace 2006 ; 8(11) : 935 42. Rechercher l’abstract
30. Marrouche NF et al. N Engl J Med 2018 ; 378(5) : 417 27. Rechercher l’abstract
31. Carlsson J et al. Am Coll Cardiol 2003 ; 41(10) : 1690 6. Rechercher l’abstract
32. Wyse DG et al. N Engl J Med 2002 ; 347(23) : 1825 33. Rechercher l’abstract
33. Roy D et al. N Engl J Med 2008 ; 358(25) : 2667 77. Rechercher l’abstract
34. Packer DL et al. JAMA 2019 ; 321(13) : 1261 74. Rechercher l’abstract
35. Cosedis Nielsen J et al. N Engl J Med 2012 ; 367(17) : 1587 95. Rechercher l’abstract
36. Duytschaever M et al. Eur Heart J 2018 ; 39(16) : 1429 37. Rechercher l’abstract
37. Darkner S et al. Eur Heart J 2014 ; 35(47) : 3356 64. Rechercher l’abstract
38. Zhang Y-Y et al. Am J Cardiol 2013 ; 112(1) : 79 84. Rechercher l’abstract
39. Bunch TJ et al. Heart Rhythm 2013 ; 10(9) : 1257 62. Rechercher l’abstract
40. Andrade JG et al. Am Heart J 2018 ; 206 : 94 104. Rechercher l’abstract
41. Kirchhof P et al. New Eng J Med [Internet] 2020 [cité 1 nov 2020] ; 383(14) : 1305 16. Disponible sur : https://doi.org/10.1056/NEJMoa2019422 Rechercher l’abstract
42. Kirchhof P et al. N Engl J Med 2020 ; 383(14) : 1305 16. Rechercher l’abstract
Gestational Diabetes Carries CVD Risk Years Later

Erica P. Gunderson, PhD
Women who’ve had gestational diabetes are 40% more likely to develop coronary artery calcification later in life than those who have never had it, and attaining normal glycemic levels doesn’t diminish their midlife risk for atherosclerotic cardiovascular disease.
“The new finding from this study is that women with gestational diabetes had twice the risk of coronary artery calcium, compared to women who never had gestational diabetes, even though both groups attained normal blood sugar levels many years after pregnancy,” lead author Erica P. Gunderson, PhD, MS, MPH, said in an interview about a community-based prospective cohort study of young adults followed for up to 25 years, which was published in Circulation (2021 Feb 1. doi: 10.1161/CIRCULATIONAHA.120.047320).
Previous studies have reported a higher risk of heart disease in women who had gestational diabetes (GD) and later developed type 2 diabetes, but they didn’t elucidate whether that risk carried over in GD patients whose glycemic levels were normal after pregnancy. In 2018, the American College of Cardiology/American Heart Association Cholesterol Clinical Practice Guidelines specified that a history of GD increases women’s risk for coronary artery calcification (CAC).
This study analyzed data of 1,133 women ages 18-30 enrolled in the Coronary Artery Risk Development in Young Adults (CARDIA) study who had no diabetes in the baseline years of 1985-1986 and had given birth at least once in the ensuing 25 years. They had glucose tolerance testing at baseline and up to five times through the study period, along with evaluation for GD status and coronary artery calcification CAC measurements at least once at years 15, 20 and 25 (2001-2011).
CARDIA enrolled 5,155 young Black and White men and women ages 18-30 from four distinct geographic areas: Birmingham, Ala.; Chicago; Minneapolis; and Oakland, Calif. About 52% of the study population was Black.
Of the women who’d given birth, 139 (12%) had GD. Their average age at follow-up was 47.6 years, and 25% of the GD patients (34) had CAC, compared with 15% (149/994) in the non-GD group.
Gunderson noted that the same relative risk for CAC applied to women who had GD and went on to develop prediabetes or were diagnosed with type 2 diabetes during follow-up.https://659177c6dbc0aa51a616452f311f1d01.safeframe.googlesyndication.com/safeframe/1-0-37/html/container.html
Risks Persist Even in Normoglycemia
In the GD group, the adjusted hazard ratio for having CAC with normoglycemia was 2.3 (95% confidence interval, 1.34-4.09). The researchers also calculated HRs for prediabetes and incident diabetes: 1.5 (95% CI, 1.06-2.24) in no-GD and 2.1 (95% CI, 1.09-4.17) for GD for prediabetes; and 2.2 (95% CI, 1.3-3.62) and 2.02 (95% CI, 0.98-4.19), respectively, for incident diabetes (P = .003).
“This means the risk of heart disease may be increased substantially in women with a history of gestational diabetes and may not diminish even if their blood-sugar levels remain normal for years later,” said Gunderson, an epidemiologist and senior research scientist at the Kaiser Permanente Northern California Division of Research in Oakland.
“The clinical implications of our findings are that women with previous GD may benefit from enhanced traditional CVD [cardiovascular disease] risk factor testing – i.e., for hypertension, dyslipidemia, and hyperinsulinemia,” Gunderson said. “Our findings also suggest that it could be beneficial to incorporate history of GD into risk calculators to improve CVD risk stratification and prevention.”
Strong Findings Argue for More Frequent CVD Screening
These study results may be the strongest data to date on the long-term effects of GD, said Prakash Deedwania, MD, professor of cardiology at the University of California, San Francisco. “It’s the strongest in the sense in that it’s sponsored, involved four different communities in different parts of the United States, enrolled individuals when they were young and followed them, and saw very few patients drop out for such a long-term study.” The study reported follow-up data on 72% of patients at 25 years, a rate Deedwania noted was “excellent.”
“Patients who have had GD should be screened aggressively – for not only diabetes, but other cardiovascular risk factors – early on to minimize the subsequent risk of cardiovascular disease is a very important point of this study,” he added. In the absence of a clinical guideline, Deedwania suggested women with GD might have screening for CV risk factors every 5-7 years depending on their risk profile, but emphasized that parameter isn’t settled.
Future research should focus on the link between GD and CVD risk, Gunderson said. “Research is needed to better characterize the severity of GD in relation to CVD outcomes, and to identify critical pregnancy-related periods to modify cardiometabolic risk.” The latter would include life-course studies across the full pregnancy continuum from preconception to lactation. “Interventions for primary prevention of CVD and the importance of modifiable lifestyle behaviors with the highest relevance to reduce both diabetes and CVD risks during the first year postpartum merit increased research investigation,” she added.https://659177c6dbc0aa51a616452f311f1d01.safeframe.googlesyndication.com/safeframe/1-0-37/html/container.html
Future studies might also explore the role of inflammation in the GD-CVD relationship, Deedwania said. “My hypothesis is, and it’s purely a hypothesis, that perhaps the presence of coronary artery calcification scores score in these individuals who were described as having normal glucose but who could be at risk could very well be related to the beginning of inflammation.”
Gunderson and Deedwania have no financial relationships to disclose. The study was funded by the National Institute of Diabetes and Digestive and Kidney Diseases and the National Heart, Lung, and Blood Institute.
This article originally appeared on MDedge.com, part of the Medscape Professional Network.
Medscape Medical News © 2021 WebMD, LLC
Cite this: Gestational Diabetes Carries CVD Risk Years Later – Medscape – Feb 01, 2021.
Curious Variation in Atrial Fib Incidence, Mortality Across Europe

The prevalence of atrial fibrillation (AF) and its related mortality have been holding fairly steady in Europe overall during the past 3 decades, but a more discriminating data dive shows they vary widely among individual European nations and indicates what may seem like a paradox, researchers say. The arrhythmia has become more common and more deadly over the years in some countries but not others, and those where AF-related mortality is climbing fastest are among the continent’s most affluent.
The findings clash with perceptions of a worsening AF epidemic internationally as the industrialized world’s elder population grows and that health outcomes are better in countries with more robust economies, the group proposes.
Also in their analysis, based on 28 years of numbers from 20 European Union members as documented in the 2017 Global Burden of Disease Database, AF prevalence and related mortality were consistently higher for women than for men, and their per-case mortality rose faster. That mortality gap between the sexes, it shows, widened at a faster pace in some countries than in others.
There was an overall pattern of constant AF incidence rates and AF-related mortality across Europe from 1990 through 2017, but with broad heterogeneity by country, Becker M. Al-Khayatt, MBBS, told theheart.org | Medscape Cardiology. “Each country has its own trends that would benefit from a national investigation of AF burden levels.”
Al-Khayatt, from Croydon University Hospitals NHS Trust, London, and the international Medical Data Research Collaborative, is lead author on the January 25 publication of the analysis in the European Heart Journal.
Variable Variation by Country
“Austria, Denmark, and Sweden have incidences peaking in the middle of the study period which then decline toward the end,” the group’s report states as examples of such trends. “Italy has a sharp rise in incidence in the late 1990s, and in Portugal there is a period of rapid decline in AF incidence between 2006 and 2009.”
Mortality related to AF rose faster than AF incidence in countries with the highest gross domestic products (GDP), especially Sweden, Denmark, and Germany, the group reports. Despite those nations’ relative affluence, notes the report, their AF incidence and mortality significantly exceeded countries with the lowest GDPs, including a number of Eastern European countries and Baltic states.
“Mortality attributable to AF per case,” it contends, “has not improved over time and in many nations is actually increasing, despite apparent advances in AF care.”
That’s surprising, Al-Khayatt said. “There’s almost a failure to improve the situation even with all the various additions to our treatment arsenal,” including better understanding of rhythm control and rate control therapies, the advent of catheter ablation, strides in oral anticoagulation, and improved services for following patients clinically.
The observed patterns don’t apply to individuals, nor should they be extrapolated to other world regions, he cautioned. Within each country, the patterns would break down at the individual level and so shouldn’t be interpreted as “being affluent puts you at increased risk,” Al-Khayatt said. And “Europe in general is quite affluent. Even the country with the lowest median GDP was still above average compared to the rest of the world.”
Other countries covered by the analysis were Belgium, Bulgaria, Croatia, Czech Republic, Finland, France, Greece, Hungary, Ireland, Italy, the Netherlands, Poland, Portugal, Romania, Spain, and the United Kingdom.
As to explanations for the curious findings, the authors could only speculate. “A survivor effect is one possibility, with patients surviving long enough to suffer AF and its adverse consequences in higher-GDP countries,” they write.
Differences in screening capability may be involved, Al-Khayatt proposed. For example, there may be variation in whether a country’s healthcare system can afford to include electrocardiography at routine clinic visits, “or just more guidance for healthcare staff in looking for atrial fib.” And, he added, “there are probably some underlying cultural differences that might explain it, as well as the actual intrinsic differences in how healthcare works in each country.”
Variation in Sex Disparities
In all countries, the estimated AF case-fatality rate was higher for women than for men. Germany had the greatest increase in disparity between women and men over the study period; the case fatality rate was 43.6% higher for women than men in 1990 and 74.5% higher in 2017. At the other extreme, the case fatality rate for women in Bulgaria was only 5.4% higher than the men’s rate.
“There are probably multiple reasons for the disparities,” Al-Khayatt said. Perhaps there are biologic or pathophysiologic differences between women and men, such as in AF-related thromboembolic risk. “Or it might be that women present a bit later and are treated less aggressively when AF does occur,” he said. “There might be some kind of intrinsic bias in terms of treating women versus men. Obviously, this is something that’s worth looking into.”
Al-Khayatt and coauthors had no disclosures.
Eur Heart J. Published online January 25, 2021. Full text
Medscape Medical News © 2021
Cite this: Curious Variation in Atrial Fib Incidence, Mortality Across Europe – Medscape – Jan 29, 2021.
Bonne nouvelle : le diabète n’est plus un facteur de risque d’infarctus du myocarde ?

Bernard BAUDUCEAU, Hôpital d’Instruction des Armées Bégin, Saint-Mandé
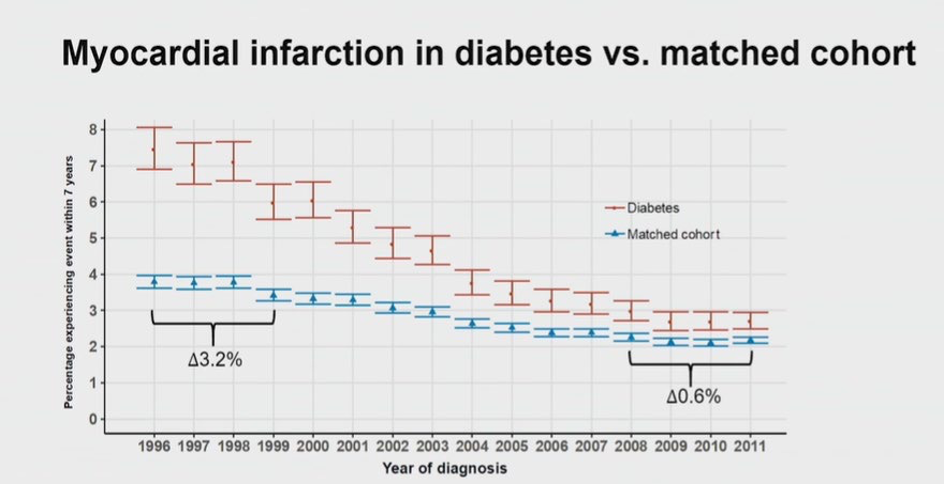
Ce titre provoquant se fonde sur l’exploitation des données des registres danois qui montrent une diminution régulière et spectaculaire de l’incidence des infarctus du myocarde et de la mortalité chez les patients diabétiques. Ces chiffres rejoignent presque ceux d’une population témoin comme le montrent les résultats présentés lors de l’ESC en 2020. Pourtant, l’incidence des complications cardiovasculaires, et notamment de l’infarctus du myocarde est habituellement considérée comme majorée d’un facteur 2 à 3 chez les patients diabétiques.
Cette étude de suivi a été menée grâce au croisement des données des registres danois portant sur le diabète et la maladie coronarienne. La cohorte étudiée se composait de patients ayant fait l’objet d’une coronarographie entre 2003 et 2012. Ces sujets ont été stratifiés en fonction de l’existence d’une maladie coronarienne et d’un diabète. Les critères d’évaluation comprenaient la survenue d’un infarctus du myocarde, de la réalisation d’une revascularisation coronarienne, d’un décès d’origine cardiaque ou de la mort toutes causes confondues.
Au total, 86 202 patients dont 12 652 personnes diabétiques ont été inclus et ont fait l’objet d’un suivi médian de 8,8 ans. En prenant pour référence les patients ne présentant ni maladie coronarienne ni diabète dont l’incidence cumulée d’infarctus du myocarde était 2,6 %, ce risque n’était que très discrètement majoré à 3,2 % chez les patients diabétiques sans coronaropathie (HR = 1,202 ; IC 95% : 0,996-1,451). Cette incidence de la survenue d’un infarctus du myocarde était augmentée et atteignait 9,3 % chez les patients atteints de coronaropathie sans diabète associé (HR = 2,75 ; IC95% : 2,52-3,01) et était la plus élevée à 12,3 % chez les patients atteints à la fois de maladie coronarienne et de diabète (HR = 3,79 ; IC95% : 3,43-4,20). Des résultats similaires ont été observés pour la fréquence de la mort d’origine cardiaque et de la revascularisation coronarienne.
Ainsi dans cette étude, les patients diabétiques sans coronaropathie authentifiée par une coronarographie ont un faible risque d’infarctus du myocarde qui n’est pas sensiblement augmenté par rapport aux patients sans coronaropathie ni diabète. Cependant, en présence d’une maladie coronarienne, le diabète majore nettement le risque d’infarctus du myocarde. Ces résultats très satisfaisants témoignent de l’amélioration de la prise en charge des patients diabétiques et coïncident avec l’utilisation plus régulière et plus fréquente des médicaments ayant fait la preuve de leur efficacité dans la protection cardiovasculaire.
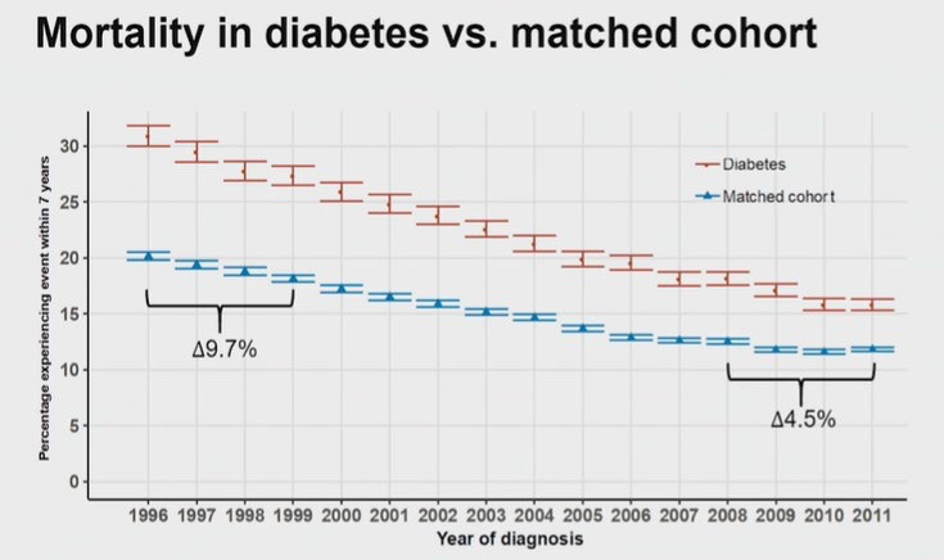
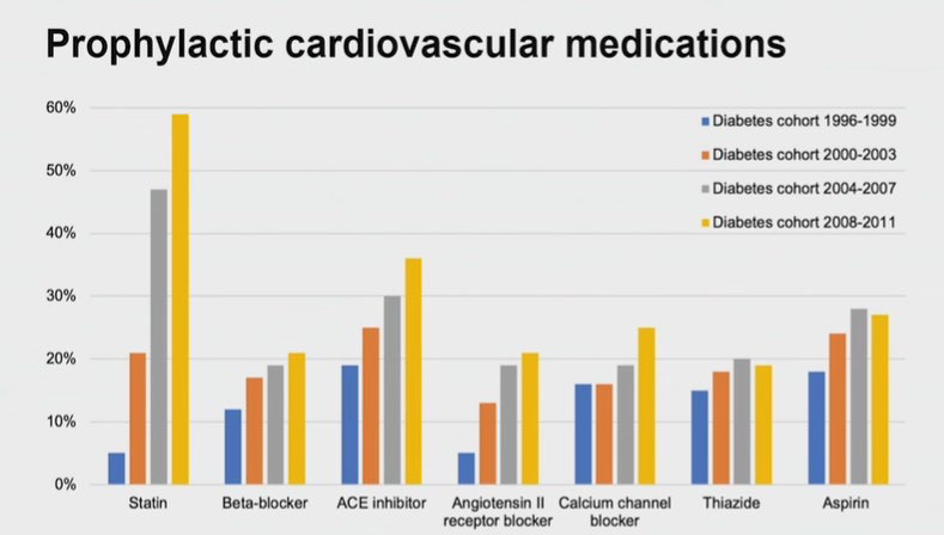
Publié par Diabétologie Pratique
Références
Cliquez sur les références et accédez aux Abstracts sur 
Gyldenkerne C et al. Diabetes is not a risk factor for myocardial infarction in patients without coronary artery disease: a study from the Western Denmark Heart Registry. Diab Vasc Dis Res 2020 ; 17 : 1479164120941809. Rechercher l’abstract